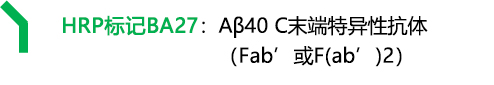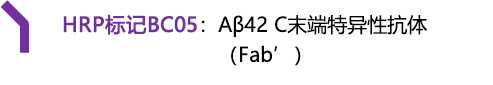小鼠SAA ELISA试剂盒是一种用于定量测定小鼠血清淀粉样蛋白A的体外酶联免疫吸附试验(ELISA)。
标签归档:elisa
64285-73-0 TMB One Solution (HRP-based ELISA) 单组分TMB显色液(ELISA,HRP显色用)
TMB One Solution 单组份TMB溶液;ELISA;HRP (Horseradish Peroxidas) 辣根过氧化物酶;DAB;CAS NO:64285-73-0;
酶联免疫分析技术(ELISA)广泛用于抗原、半抗原或抗体的定量或定性分析,辣根过氧化物酶(HRP)及其偶联物是ELISA技术常用的一种酶,能催化底物如3,3’5,5′-四甲基联苯胺(TMB)发生显色反应,从而进行定量或定性分析。由于TMB比其他显色底物具更高的灵敏度且无致癌性被广泛使用,TMB主要用于ELISA,免疫斑点杂交或免疫组化等实验,也有报道将其用于氯的检测分析。
通常TMB显色试剂由多个组分构成,必须在使用前进行配制,并且容易产生沉淀,使用相对不便且容易导致检测结果不稳定。本品采用全新的TMB显色技术,将所有相关试剂全部配在一个溶液,即仅由单一溶液组成,不仅简化了操作步骤,而且使检测结果更加稳定可靠。
本品专门为ELISA实验而设计。检测原理在于HRP或其他适当过氧化物酶能催化生成可溶的蓝色产物,此时通常可在370nm测定吸光度。当显色反应被酸性溶液(如0.5-2M H2SO4,0.5M HCl,1M H3PO4)终止后,产物由蓝色转为黄色,此时可在450nm测定吸光度。由于本品显色敏感度高,线性浓度范围较宽,极其适合用于定量ELISA分析。
本品用于ELISA检测,每个样品通常使用0.1ml显色液,则100ml本品约检测1000个样品,500ml本品约检测5000个样品。
保存与运输方法
保存:2-8℃避光保存,2年有效。
运输:冰袋运输。
注意事项
1) 本品含TMB和H2O2,对人体有刺激性,请注意防护。
2) 如发现本品出现浑浊或颜色变为蓝色,请停止使用。
3) 为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用方法(ELISA)
1) 使用之前,取出适量单组份TMB显色液,使其回到室温再开始使用;
2) 参考ELISA检测试剂盒的实验步骤,当与HRP标记抗体孵育一段时间后,用适当洗涤液洗涤3-5次,每次3-5min。
3) 洗涤完毕后,去除洗涤液,加入100μl单组份TMB显色液。
4) 室温避光孵育5-30min或更长时间(可长达24h),直至显色到预期深浅。【注意】:建议根据实验需求选择最佳试剂用量、显色时间和反应温度。
5) 直接在370nm测定吸光度。或者加入100μl 0.5-2M H2SO4终止反应,随后在450nm测定吸光度。
常用问题
1. 背景显色太深
1)如果背景(没有样品的对照)显色太深,一方面需考虑使用适当的封闭液进行封闭,如商业化封闭液或者和一抗相同来源的血清(10%)进行封闭。另一方面,使用经过适当吸附的二抗,以减小二抗的非特异性吸附。
2)可以考虑缩短显色时间,或降低二抗浓度。另外,选择适当强度的洗涤液,或延长洗涤时间也会有所帮助。
2. 没有显色或显色太弱
1)适当提高一抗或二抗的浓度。检测二抗效果,滴一滴稀释二抗在离心管内,检测二抗是否被正常显色。
2)可以考虑使用更加灵敏的放大检测体系,例如生物素检测体系。
3)可以适当延长显色时间。
4)如果上述改进不能获得预期效果,可以考虑更换效果更好的一抗或ELISA试剂盒。
相关产品
|
产品名称 |
产品编号 |
规格 |
|
|
TMB ( 3,3’,5,5’-Tetramethyl Benzidine Dihydrochloride) 3,3’5,5′-四甲基联苯胺二盐酸 |
MM2006-250MG |
250mg |
|
|
MM2006-1000MG |
1g |
|
|
|
TMB One Solution (HRP-based Blotting) 单组分TMB显色液(膜印迹,HRP显色用) |
MM0719-100ML |
100ml |
|
| MM0719-500ML | 500ml |
|
64285-73-0 TMB One Solution (HRP-based ELISA) 单组分TMB显色液(ELISA,HRP显色用)
TMB One Solution 单组份TMB溶液;ELISA;HRP (Horseradish Peroxidas) 辣根过氧化物酶;DAB;CAS NO:64285-73-0;
酶联免疫分析技术(ELISA)广泛用于抗原、半抗原或抗体的定量或定性分析,辣根过氧化物酶(HRP)及其偶联物是ELISA技术常用的一种酶,能催化底物如3,3’5,5′-四甲基联苯胺(TMB)发生显色反应,从而进行定量或定性分析。由于TMB比其他显色底物具更高的灵敏度且无致癌性被广泛使用,TMB主要用于ELISA,免疫斑点杂交或免疫组化等实验,也有报道将其用于氯的检测分析。
通常TMB显色试剂由多个组分构成,必须在使用前进行配制,并且容易产生沉淀,使用相对不便且容易导致检测结果不稳定。本品采用全新的TMB显色技术,将所有相关试剂全部配在一个溶液,即仅由单一溶液组成,不仅简化了操作步骤,而且使检测结果更加稳定可靠。
本品专门为ELISA实验而设计。检测原理在于HRP或其他适当过氧化物酶能催化生成可溶的蓝色产物,此时通常可在370nm测定吸光度。当显色反应被酸性溶液(如0.5-2M H2SO4,0.5M HCl,1M H3PO4)终止后,产物由蓝色转为黄色,此时可在450nm测定吸光度。由于本品显色敏感度高,线性浓度范围较宽,极其适合用于定量ELISA分析。
本品用于ELISA检测,每个样品通常使用0.1ml显色液,则100ml本品约检测1000个样品,500ml本品约检测5000个样品。
保存与运输方法
保存:2-8℃避光保存,2年有效。
运输:冰袋运输。
注意事项
1) 本品含TMB和H2O2,对人体有刺激性,请注意防护。
2) 如发现本品出现浑浊或颜色变为蓝色,请停止使用。
3) 为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用方法(ELISA)
1) 使用之前,取出适量单组份TMB显色液,使其回到室温再开始使用;
2) 参考ELISA检测试剂盒的实验步骤,当与HRP标记抗体孵育一段时间后,用适当洗涤液洗涤3-5次,每次3-5min。
3) 洗涤完毕后,去除洗涤液,加入100μl单组份TMB显色液。
4) 室温避光孵育5-30min或更长时间(可长达24h),直至显色到预期深浅。【注意】:建议根据实验需求选择最佳试剂用量、显色时间和反应温度。
5) 直接在370nm测定吸光度。或者加入100μl 0.5-2M H2SO4终止反应,随后在450nm测定吸光度。
常用问题
1. 背景显色太深
1)如果背景(没有样品的对照)显色太深,一方面需考虑使用适当的封闭液进行封闭,如商业化封闭液或者和一抗相同来源的血清(10%)进行封闭。另一方面,使用经过适当吸附的二抗,以减小二抗的非特异性吸附。
2)可以考虑缩短显色时间,或降低二抗浓度。另外,选择适当强度的洗涤液,或延长洗涤时间也会有所帮助。
2. 没有显色或显色太弱
1)适当提高一抗或二抗的浓度。检测二抗效果,滴一滴稀释二抗在离心管内,检测二抗是否被正常显色。
2)可以考虑使用更加灵敏的放大检测体系,例如生物素检测体系。
3)可以适当延长显色时间。
4)如果上述改进不能获得预期效果,可以考虑更换效果更好的一抗或ELISA试剂盒。
相关产品
|
产品名称 |
|
规格 |
|
|
TMB ( 3,3’,5,5’-Tetramethyl Benzidine Dihydrochloride) 3,3’5,5′-四甲基联苯胺二盐酸 |
|
250mg |
|
|
|
1g |
|
|
|
TMB One Solution (HRP-based Blotting) 单组分TMB显色液(膜印迹,HRP显色用) |
|
100ml |
|
| 500ml |
|
LBIS® 兔血清载脂蛋白B-48(ApoB-48)ELISA 试剂盒 LBIS® Rabbit ApoB-48 ELISA Kit
LBIS® 兔血清载脂蛋白B-48(ApoB-48)ELISA 试剂盒
LBIS® Rabbit ApoB-48 ELISA Kit
- 产品特性
- 相关资料
- Q&A
- 参考文献
![]() LBIS® Rabbit ApoB-48 ELISA Kit
LBIS® Rabbit ApoB-48 ELISA Kit
LBIS®兔血清载脂蛋白B-48(ApoB-48)ELISA 试剂盒
血浆脂蛋白(plasma lipoprotein)是由一定比例的脂质和蛋白质组成的复合体,负责血清脂质的转运。其表面构造含有载脂蛋白,并且发挥重要作用,例如稳定脂蛋白结构,激活与脂蛋白代谢有关的酶,与细胞表面上的脂蛋白受体结合等。载脂蛋白 B48(ApoB-48)的分子量为 264000,结构上含有载脂蛋白 B100 的 48% 的氨基酸序列,存在于 VLDL、LDL、HDL 的载脂蛋白 B100,它在由肝脏来源的血浆脂蛋白中可以运输内源性脂质。脂蛋白乳糜微粒(Chylomicron、CM)将来自食物等的外源性脂质转运到肝脏和外周组织,ApoB-48 是在小肠中制造的,是 CM 特异的结构蛋白。因此,通过测定 ApoB-48,来观察进食后的脂蛋白变化是较为合适的。此外,通过测量同一样品中的 LDL-、HDL-胆固醇和 B48,可以分析外源胆固醇和内源性胆固醇的变化(参考文献2)。对于在心脏血管中引起粥样硬化症的原因之一的 CM 残留的评估也有帮助作用。
◆特点·构成
试剂盒的特点
● 短时间即可测定(完全反应时间:2 小时 50 分钟)
● 微量标品即可测定(标准操作用量 10 μL)
● 使用环保型防腐剂
● 高测量精度和可重复性
● 兔源标准品
试剂盒的构成
|
试剂盒组成 |
使用方法 |
规格 |
|
(A) 抗体固相化 96 孔板 |
清洗后使用 |
96 wells(8×12)/1 个 |
|
(B) 标准品(冷冻干燥) |
稀释后使用 |
1000 ng/1 瓶 |
|
(C) 缓冲液 |
直接使用 |
60 mL/1 瓶 |
|
(D) 生物素缀合的抗 apo B-48 抗体 |
稀释后使用 |
100 μL/1 瓶 |
|
(E) 过氧化物酶 · 抗生物素蛋白结合物 |
稀释后使用 |
100 μL/1 瓶 |
|
(F) 显色液(TMB) |
直接使用 |
12 mL/1 瓶 |
|
(H) 反应停止液(1M H2SO4) ※ 使用注意 |
直接使用 |
12 mL/1 瓶 |
|
(I) 浓缩洗涤液(10×) |
稀释后使用 |
100 mL/1 瓶 |
|
板盖 |
1 个 |
|
|
使用说明书 |
1 份 |
◆检测样品信息
兔血清·血浆(柠檬酸钠不可用)
50 μL/孔(稀释样品)
*样品稀释标准是10倍。 昂贵的样品可根据需要稀释10倍或以上。
◆检测范围
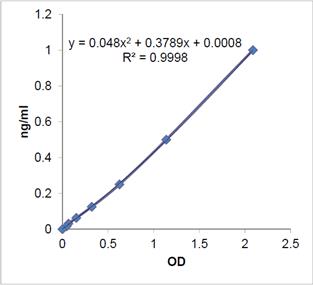
19.5~1250 ng/mL(校准曲线范围)
◆Validation data
精度测试(组内变异)
| 检测样品 |
A |
B |
C |
|
1 |
543 |
185 |
78.2 |
|
2 |
532 |
182 |
78.2 |
|
3 |
537 |
179 |
74.1 |
|
4 |
535 |
182 |
75.6 |
|
5 |
550 |
184 |
75.9 |
|
mean |
539 |
182 |
76.4 |
|
SD |
7.37 |
2.19 |
1.76 |
|
CV(%) |
1.4 |
1.2 |
2.3 |
单位:ng/mL
重复性测试(组间变异)
| 测定日/检测样品 |
F |
G |
|
0日 |
402 |
103 |
|
1日 |
399 |
102 |
|
2日 |
398 |
105 |
|
3日 |
401 |
102 |
|
mean |
400 |
103 |
|
SD |
2.08 |
1.31 |
|
CV(%) |
0.52 |
1.3 |
单位:ng/mL,n=2
加标回收测试
检测样品 D
|
添加量 |
实际测量值 |
回收量 |
回收率(%) |
|
0 |
84.4 |
– |
– |
|
21.6 |
105 |
20.6 |
95.4 |
|
47.5 |
133 |
48.6 |
102 |
|
67.9 |
155 |
70.6 |
104 |
单位:ng/mL,n=2
检测样品 H
|
添加量 |
实际测量值 |
回收量 |
回收率(%) |
|
0 |
326 |
– |
– |
|
243 |
553 |
227 |
93.4 |
|
495 |
846 |
520 |
105 |
|
730 |
1063 |
737 |
101 |
单位:ng/mL,n=2
线性稀释实验
将2种血清样品用稀释缓冲液连续稀释3次,测定结果,线性回归方程中 R2 为 0.9987~0.9996。
◆产品信息
非临床研究用测量试剂
脂质代谢研究领域
载脂蛋白
|
产品编号 |
产品名称 |
产品规格 |
校准曲线范围 |
样品量(稀释样品) |
|
628-04901 |
Rabbit ApoB-48 ELISA Kit
兔血清载脂蛋白B-48(ApoB-48)ELISA 试剂盒
|
96 tests |
19.5~1250 ng/mL |
50 μL |
点击此处下载产品系列彩页,或向当地代理商索要纸质版本
点击此处下载产品彩页
参考文献
|
1. |
Determination of apolipoprotein B-48 in serum by a sandwich ELISA.Kinoshita,M., Kojima,M., Matsushima,T., and Teramoto,T. Clinica Chimica Acta, 351:115-120, 2005 |
|
2. |
Effects of intensive atorvastatin and rosuvastatin treatment on apolipoprorein B-48 and remnant lipoprotein cholesterol levels. Otokozawa,S.,Ai,M.,Van,Himbergen,T.,Asztalos,BF.,Tanaka,A.,Stein,EA.,Jones,PH.,Schaefer,EJ. Atherosclerosis,205:197-201,2009 |
|
3. |
Determination of apolipoprotein B-48 in serum by a sandwich ELISA. Kinoshita,M., Kojima,M., Matsushima, T., and Teramoto,T.Clinica Chimica Acta, 351:115-120, 200 |
|
4. |
Effects of intensive atorvastatin and rosuvastatin treatment on apolipoprorein B-48 and remnant lipoprotein cholesterol levels. Otokozawa,S.,Ai,M.,Van,Himbergen,T.,Asztalos,BF.,Tanaka,A.,Stein,EA.,Jones,PH.,Schaefer,EJ.Atherosclerosis,205:197-201,2009 |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 628-04901 | (AKRB48)Rabbit Apo B-48 ELISA Kit 兔血清载脂蛋白B-48(ApoB-48)ELISA试剂盒 |
96 tests |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
LBIS® 大鼠生长激素(GH) ELISA试剂盒 LBIS® Rat GH ELISA Kit
LBIS® 大鼠生长激素(GH) ELISA试剂盒
LBIS® Rat GH ELISA Kit
- 产品特性
- 相关资料
- Q&A
- 参考文献
![]()
大鼠生长激素(GH) ELISA试剂盒
生长激素(Growth hormone,别名Somatotrop(h)ic hormone、 STH、 Somatotrop(h)in)主要是由垂体前叶嗜酸性腺垂体分泌的蛋白激素,在大脑和淋巴细胞表达。与GH高度相似的GH2表达于人的胎盘。GH作用于肝脏、肌肉、肾脏、软骨细胞、成纤维细胞、胸腺上皮细胞。在IGF-1作用下,通过软骨细胞的增殖、硫酸软骨素的合成、肝脏其他器官细胞肥大增殖、促蛋白合成等促进生长,对胸腺细胞分泌胸腺素起到促进作用。GH暂时性表达胰岛素样作用,之后在脂肪细胞中通过脂肪分解增加游离脂肪酸、血糖上升、胰岛素拮抗作用抑制糖分解、肌肉中糖原含量增加、末梢组织胰岛素灵敏性下降等代谢方面起到一定双相性作用。还起到类似催乳素作用对Na、K、Mg、Ca、P的存积、促进小肠Ca吸收、乳腺发育、乳汁分泌等作用。
GHRH、生长素释放肽、甲状腺激素、皮质醇、视黄酸均可促进GH合成分泌。另外通过胰高血糖素、加压素、2-脱氧-D-葡萄糖耐受性、精氨酸等酸负载、蛋白质摄入、TF5、β-内啡肽、左旋多巴、肾上腺素α受体刺激等可促进GH分泌。促进GH分泌的生理状态是低血糖、应激(发热,外伤,出血,乙醚麻醉,精神焦虑)、空腹、运动、慢波睡眠等。GH分泌会抑制引起促生长素抑制素(SRIF)、活化素、肾上腺素β受体刺激、葡萄糖、游离脂肪酸、皮质类固醇投放、高浓度IGF-1、高浓度GH等现象发生。抑制GH分泌的生理状态是高血糖、增加血液中的脂肪、异相睡眠等。GH分泌是具有episodic性的。也就是说可间隔性地使血糖浓度急剧上升或下降。因此非人为采血时血中GH水平会变化很大。
◆特点
● 测定时间短(总反应时间:5小时)
● 微量样本(标准操作法5 μL)即可测定。
● 使用无害的防腐剂。
● 全部试剂为溶液即用类型。
● 高测定精度和高重复性。
◆试剂盒组成
|
组成品 |
状态 |
包装 |
|
抗体包被96孔板 |
清洗后使用 |
96 wells(8×12)/1个 |
|
标准溶液(20 ng/mL) |
稀释后使用 |
100 μL/1瓶 |
|
缓冲液 |
直接使用 |
60 mL/1瓶 |
|
生物素结合抗GH抗体 |
稀释后使用 |
100 μL/1瓶 |
|
过氧化物酶·抗生素结合物 |
稀释后使用 |
100 μL/1瓶 |
|
显色液(TMB) |
直接使用 |
12 mL/1瓶 |
|
终止液(1M H2SO4) ※小心轻放 |
直接使用 |
12 mL/1瓶 |
|
浓缩清洗液(10×) |
稀释后使用 |
100 mL/1瓶 |
|
孔板密封膜 |
4个 |
|
|
产品说明书 |
1本 |
物种交叉性
2000 pg/mL时数据+:有交叉性 ―:无交叉性
|
动物种类 |
对象物质 |
反应性及反应率(%) |
|
大鼠 |
r-GH |
100 |
|
Prolactin |
0.02 |
|
|
Placental lactogen |
0.02 |
|
|
TSH |
― |
|
|
LH |
― |
|
|
FSH |
― |
|
|
小鼠 |
GH |
+ |
|
TSH |
― |
◆样本信息
● 大鼠血清·血浆
● 5 μL/well(标准操作法)
※ 样本量可调节范围:5~25 μL。但需用缓冲液将板孔总量调制至50 μL
※ 推荐使用1 mg/mL (终浓度)EDTA作为抗凝剂。
◆测定范围
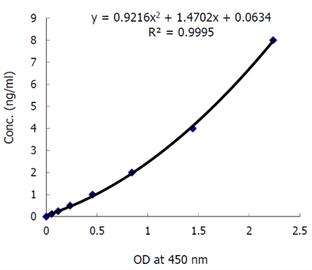
● 31.3~2,000 pg/mL(标准曲线范围)
● 62.6~4,000 pg/mL(样本量25 μL时)
● 0.313~20 ng/mL(标准操作时)
◆实验数据
精度测试(组内变异)
|
样本 |
A |
B |
|
1 |
262 |
864 |
|
2 |
247 |
837 |
|
3 |
250 |
813 |
|
4 |
258 |
775 |
|
5 |
251 |
780 |
|
6 |
257 |
800 |
|
7 |
254 |
771 |
|
8 |
270 |
779 |
|
Mean |
256 |
802 |
|
SD |
7.19 |
33.5 |
|
CV(%) |
2.8 |
4.2 |
单位:pg/mL
重复性测试(组间变异)
|
测定日/样本 |
E |
F |
G |
|
0天 |
1626 |
412 |
96.0 |
|
1天 |
1576 |
407 |
97.9 |
|
2天 |
1615 |
409 |
96.1 |
|
3天 |
1561 |
401 |
103 |
|
Mean |
1595 |
407 |
98.3 |
|
SD |
31.0 |
4.50 |
3.35 |
|
CV(%) |
1.9 |
1.1 |
3.4 |
单位:pg/mL,n=4
加标回收测试
样本C
|
添加量 |
实测值 |
回收量 |
回收率(%) |
|
0.00 |
101 |
— |
— |
|
155 |
265 |
164 |
106 |
|
192 |
285 |
184 |
95.8 |
|
223 |
325 |
224 |
100 |
单位:pg/mL,n=2
样本D
|
添加量 |
实测值 |
回收量 |
回收率(%) |
|
0.00 |
506 |
— |
— |
|
303 |
822 |
316 |
104 |
|
466 |
949 |
443 |
95.1 |
|
539 |
1058 |
552 |
102 |
单位:pg/mL,n=2
稀释直线性测试
2个血清样本连续用稀释缓冲液稀释3个梯度测定结果,直线回归值R2=0.999。
参考文献
|
1. |
Daily Fasting Blood Glucose Rhythm in Male Mice: A Role of the Circadian Clock in the Liver. Ando H, Ushijima K, Shimba S, Fujimura A. Endocrinology. 2016 Feb;157(2):463-9. |
|
2. |
Casted-immobilization downregulates glucocorticoid receptor expression in rat slow-twitch soleus muscle. Sato S., Suzuki H., Tsujimoto H., Shirato K., Tachiyashiki K., Imaizumia K. Life Sciences, Vol.89(25-26), p962-967, Dec 2011. |
|
3. |
Activation of PPARδ promotes mitochondrial energy metabolism and decreases basal insulin secretion in palmitate-treated β-cells. Jiang L., Wan J., Ke L., LU Q., Tong N. Molecular and Cellular Biochemistry, Vol.343(1-2), p249-256, Oct 2010. |
|
4. |
The CXCR4 antagonist AMD3100 suppresses hypoxia-mediated growth hormone production in GH3 rat pituitary adenoma cells. Yoshida,D.,Koketshu,K.,Nomura,R.,Teramoto,A. J Neurooncol, 2010. |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 639-13749 | (AKRGH-010)LBIS® Rat GH ELISA Kit LBIS® 大鼠生长激素(GH) ELISA试剂盒 |
96 tests | – | – |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
炎症性疾病&代谢综合征生物标记 ELISA试剂盒
炎症性疾病&代谢综合征生物标记 ELISA试剂盒
- 产品特性
- 相关资料
- Q&A
- 参考文献
![]()
炎症性疾病&代谢综合征生物标记 ELISA试剂盒
来自AbfrontierCymax™ 细胞因子ELISA试剂盒
来自JaICA氧化应激测定
◆IL-37 ELISA试剂盒 独特性!
一种新型抗炎性IL-1家族成员
IL-1家族成员——IL-37是对哮喘、肠道炎症、SLE发病机理、皮肤炎症、肥胖患者的胰岛素抵抗和心血管疾病等疾病具有调节功能的抗炎细胞因子。
REVIEWS:The Role of IL-37 in Non-Cancerous Diseases: V.A Ding, et al.; Pathol. Oncol. Res. 23, 463 (2017)
REVIEWS:Role of Anti-inflammatory Cytokines IL-35 and IL-37 in Asthma: D. Hu; Inflammation 40, 697 (2017)
REVIEWS:A protective role of IL-37 in cancer: a new hope for cancer patients: A. Abulkhir, et al.; J. Leukoc. Biol. 101, 395 (2017)
REVIEWS:The emerging role of interleukin-37 in cardiovascular diseases: X. Zhuang, et al.; Immun. Inflamm. Dis. (Epub ahead of
print) (2017)
REVIEWS:Homodimerization attenuatesthe anti-inflammatory activity of interleukin-37: A.M. Ellisdon, et al.; Sci. Immunol. 2, eaaj1548
(2017)
|
产品编号 |
产品名称 |
包装 |
|
AG-45A-0041YEK-KI01 |
白介素-37(人)ELISA 试剂盒 IL-37 (human) ELISA Kit |
96 wells |
|
AG-45A-0041YTP-KI01 |
96 wells×2 |
|
|
AG-45A-0041YPP-KI01 |
96 wells×2 |
AG-45A-0041Y规格
本实验已证明该测定法可检测天然、重组单体和二聚体人IL-37。
灵敏度:10 pg/mL
范围:16~1000 pg/mL
样品:血清、血浆Manual IL-37 (human) ELISA Kit
◆Nampt / Visfatin ELISA试剂盒 标准!
代谢综合征炎症状态的生物标记物
烟酰胺磷酸核糖转移酶(Nampt; pre-B细胞集落增强因子; PBEF; Visfatin)是由脂肪组织分泌并参与烟酰胺腺嘌呤二核苷酸(NAD+)生物合成的脂肪因子。有证明指出,在不同的疾病如糖尿病、肥胖症、动脉粥样硬化、胎儿生长迟缓、败血症、炎症性肠病(IBD)、克罗恩病、类风湿性关节炎、先兆子痫和各种癌症中,Nampt表达增强。
REVIEWS:Nampt and its potential role in inflammation and type 2 diabetes: A. Garten, et al.; Handb.Exp. Pharmacol. 203 ,147 (2011)
REVIEWS:Adipose tissue dysfunction and inflammation in cardiovascular disease: N. Wronkowitz, et al.; Front. Horm. Res. 43, 79
(2014)
REVIEWS:The role of visfatin (PBEF/Nampt) in pregnancy complications: T. Pavlova, et al.; J. Reprod. Immunol.112, 102 (2015)
REVIEWS:New markers of insulin resistance in polycystic ovary syndrome: K. Polak, et al.; J. Endocrinol. Invest. 40,1 (2017)
|
产品编号 |
产品名称 |
规格 |
|
|
AG-45A-0006YEK-KI01 |
Nampt (内脂素/PBEF)(人) ELISA 试剂盒 Nampt (Visfatin/PBEF) (human) ELISA Kit |
96 wells |
|
|
AG-45A-0006YTP-KI01 |
Nampt(内脂素/PBEF)(人) ELISA 试剂盒(2盒) Nampt (Visfatin/PBEF) (human) ELISA Kit (Twin Plex) |
96 wells×2 |
|
|
AG-45A-0006YPP-KI01 |
Nampt(内脂素/PBEF)(人) ELISA 试剂盒 (5盒) Nampt (Visfatin/PBEF) (human) ELISA Kit (Penta Plex) |
96 wells×5 |
|
|
AG-45A-0008YEK-KI01 |
NAMPT(内脂素/ PBEF)(人)(胞内)ELISA试剂盒 Nampt (Visfatin/PBEF) (human) (IntraCellular) ELISA Kit |
96 wells |
|
|
AG-45A-0008YTP-KI01 |
NAMPT(内脂素/PBEF)(人)(胞内)ELISA试剂盒(2盒) Nampt (Visfatin/PBEF) (human) (IntraCellular) ELISA Kit (Twin Plex) |
96 wells×2 |
|
|
AG-45A-0007YEK-KI01 |
Nampt(内脂素/PBEF)(小鼠/大鼠) 双 ELISA 试剂盒 Nampt (Visfatin/PBEF) (mouse/rat) Dual ELISA Kit |
96 wells×2 |
|
|
AG-45A-0007YTP-KI01 |
Nampt(内脂素/PBEF)(小鼠/大鼠) 双 ELISA 试剂盒(2盒) Nampt (Visfatin/PBEF) (mouse/rat) Dual ELISA Kit (Twin Plex) |
96 wells×2 |
|
AG-45A-0006Y规格
检测天然和重组人Nampt。
灵敏度:30 pg/mL
范围:125~8000 pg/mL
样品:血清
◆Irisin ELISA试剂盒 标准!
能量代谢生物标记
Irisin是由小鼠和人类骨骼肌分泌的运动激素。 Irisin通过增加能量消耗来改善全身新陈代谢。循环虹膜水平在急性运动后会上调,且与能量代谢、肥胖、2型糖尿病(T2D)、胰岛素抵抗和慢性阻塞性肺疾病(COPD)有关。
REVIEWS:LIT:Irisin, a novel myokine is an independent predictor for sarcopenia and carotid atherosclerosis in dialysis patients: M.J.
REVIEWS:Lee,et al.; Atheroscler. 242, 476 (2015)
REVIEWS:Chronic CNS oxytocin signaling preferentially induces fat loss in highfat diet-fed rats by enhancing satiety responses and
REVIEWS:increasing lipid utilization: J.E. Blevins, et al.; Am. J. Physiol. 310, R640 (2016)
REVIEWS:Eicosapentaenoic acid regulates brown adipose tissue metabolism in high-fat-fed mice and in clonal brown adipocytes:
REVIEWS:M. Pahlavanni, et al.; J. Nutr. Biochem.39, 101 (2017)
|
产品编号 |
产品名称 |
包装 |
|
AG-45A-0046YEK-KI01 |
新型瘦素竞争ELISA 试剂盒 Irisin Competitive ELISA Kit |
96 wells |
|
AG-45A-0046YTP-KI01 |
新型瘦素竞争 ELISA 试剂盒 (2盒) Irisin Competitive ELISA Kit (Twin Plex) |
96 wells×2 |
|
AG-45A-0046YPP-KI01 |
新型瘦素竞争ELISA 试剂盒 (5盒) Irisin Competitive ELISA Kit (Penta Plex) |
96 wells×5 |
AG-45A-0046Y规格
检测天然和重组人类虹膜蛋白。 基于100%序列同一性,也可在小鼠、大鼠和猴等生物样品中起作用。 不与FNDC4交叉反应。
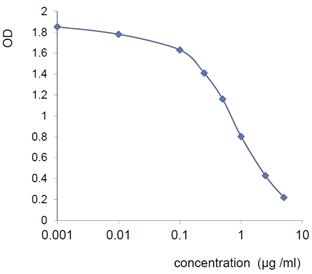
灵敏度:1 ng/mL
范围:0.001~5 μg/mL
样品:血清,血浆,细胞培养上清液
◆锌-α-2-糖蛋白的ELISA试剂盒 Turbo ELISA™
脓毒症代谢综合征生物标记物
ZAG以脂肪因子的形式主要在白色脂肪库和小鼠的肩胛内棕色脂肪中表达。它可能通过对脂联素产生的影响来参与调节肥胖和代谢。 ZAG在糖尿病患者的尿液中含量上调,据报道与癌症和代谢综合征等多种疾病有关。最近,有证明指出血清中的ZAG水平在急性脓毒症中减少并且在临床恢复期间上升。
REVIEWS:Zinc alpha 2-glycoprotein: a multidisciplinary protein: M.I. Hassan, et al.; Mol. Cancer Res. 6, 892 (2008)
REVIEWS:Zinc-α2-glycoprotein: an adipokine modulator of body fat mass? C. Bing, et al.; Int. J. Obes. (Lond).34, 1559 (2010)
REVIEWS:Zinc-α2-glycoprotein as a marker of fat catabolism in humans: A. Cabassi& S. Tedeschi; Curr.
REVIEWS:Opin.Clin. Nutr.Metab. Care 16, 267 (2013)
|
产品编号 |
产品名称 |
包装 |
|
AG-48B-1000-KI01 |
锌 – α-2-糖蛋白(人)Turbo ELISA™ 试剂盒 Zinc-alpha-2-glycoprotein (human) TurboELISA™ Kit |
1 kit |
|
AG-46B-0008-KI01 |
锌-alpha-2糖蛋白检测套装 Zinc-alpha-2-glycoprotein (human) Matched Pair Detection Set |
1 set |
AG-48B-1000的规格
检测天然和重组人锌-α-2-糖蛋白。不可检测小鼠锌-α-2-糖蛋白。
该检测方法是耗时小于1小时,用于定量检测生物体液中人ZAG的夹心Elisa法。
灵敏度:0.23 ng/mL
范围:0.9375~60 ng/mL
样品:血清、血浆、细胞培养上清液
另外提供:元素分析:Ca,Cu,Fe,Mg,Zn,UIBC
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
β-Amyloid ELISA 试剂盒 β-Amyloid ELISA kit
β-Amyloid ELISA 试剂盒
β-Amyloid ELISA kit
- 产品特性
- 相关资料
- Q&A
- 参考文献
β-Amyloid ELISA 试剂盒
——定量检测 Aβ40/Aβ42
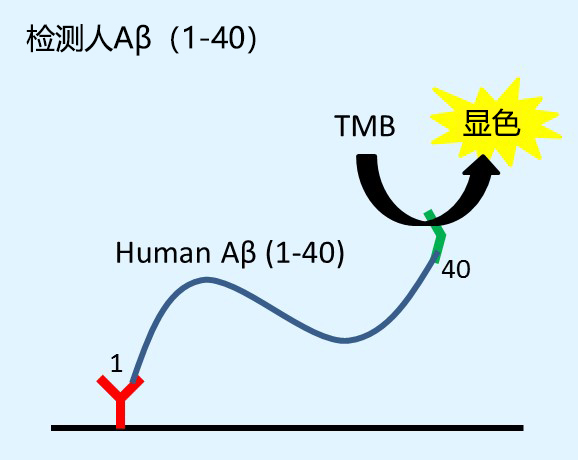
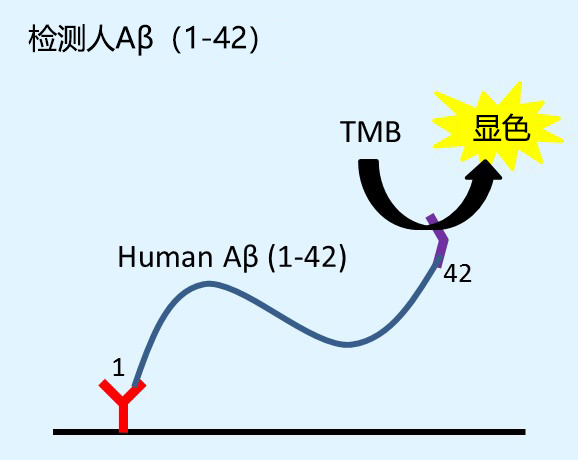
阿尔茨海默症(Alzheimer's Disease, AD),俗称老年痴呆症,其特征是在大脑神经细胞中存在老年斑(Senile Plaques,SPs) 和神经元纤维缠结(Neuro Fibrillary Tangles,NFT),老年斑的主要组成蛋白是 β- 淀粉样多肽(Amyloid Peptide,Aβ)40 和 42(43),Aβ42 比 Aβ40 更容易发生聚集。因此,蛋白样多肽的聚集开始于 Aβ42 而不是 Aβ40。出现了 Aβ42 而没有出现 Aβ40 是阿 尔茨海默症的早期特征;出现了 Aβ40,尤其是在成熟老年斑的中心部分出现则代表进入阿尔茨海默症的晚期阶段。
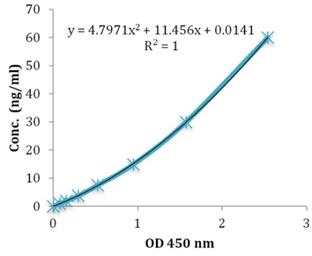
本产品可检测与阿尔茨海默病相关的淀粉样蛋白β 蛋白质(1-40)以及淀粉样蛋白β 蛋白质(1-42)的高灵敏度 ELISA 试剂盒。与以往试剂盒相比较,检测灵敏度提高约 10 倍,检测范围在 0.1~20.0(pmol/L)。
另外,因为以往产品同样标志抗体Fab’化,非特异性结合降低。由于运用的是武田药品工业株式会社开发的特异性非常高的单克隆抗体,不仅是组织提取液、培养上清液、脑脊髓液,而且以前检测较困难的血浆中 Aβ40 以及 Aβ42 亦可高灵敏度检测。
◆特点
● 可检测多种样品类型:脑组织样品,培养基上清样品,脑脊髓液样品, 血浆样品等
● 特异性极强的抗体,避免非特异性结合
BAN50:Aβ肽N末端1-16 特异性
BNT77:Aβ11-28特异性
BA27:Aβ40 C末端特异性
BC05:Aβ42 C末端特异性
● 极高的灵敏度,可检测至 pmol 级含量
● 使用此产品的文章已在 Science、Biochemistry、Neuron 等多家国际顶尖刊物发表
|
产品 |
Wako 产品 |
A 产品 |
对比优势 |
|
产品名称 |
Human/Rat beta (40) ELISA Kit Wako |
Human 40 ELISA Kit |
|
|
检测原理 |
夹心法 ELISA |
夹心法 ELISA |
|
|
使用的抗体 |
包被的抗体,HRP标记的检测抗体 |
包被的抗体,检测抗体,HRP标记的识别检测抗体的抗体 |
Wako产品检测需2个抗体,而A产品需3个抗体 |
|
检测物种 |
人,小鼠,大鼠 |
人 |
Wako产品可检测物种多于A产品 |
|
检测范围 |
1.0~100 pmol/L |
<100 pmol/L |
|
|
检测灵敏度 |
0.25 pmol/L |
1.25 pmol/L |
Wako 产品灵敏度更高 |
|
检测样品 |
脑组织样品,培养基上清样品, 脑脊髓液样品,血浆样品 |
培养基上清,组织匀浆液,脑脊 髓液 |
◆检测原理
|
|
|
||
|
|
|
||
|
|
|
|
|
◆试剂盒种类
|
β-淀粉样蛋白ELISA试剂盒 Wako |
使用Fab'片段抗体的试剂盒,低非特异性结合。 |
|
β-淀粉样蛋白ELISA试剂盒 Wako Ⅱ |
使用F(ab’)2片段抗体的试剂盒,抗原抗体反应稳定性得到提高。 |
|
β-淀粉样蛋白ELISA试剂盒Wako,高灵敏度 |
与常规产品相比提高约10倍灵敏度的试剂盒。使用Fab'片段抗体,低非特异性结合。 |
试剂盒组成
|
抗体包被的微孔板 1 块 标准溶液 2mL×2支 标准稀释液 2 mL×2支 清洗液(20x) 50 mL×1支 HRP标记抗体溶液 12 mL×1支 TMB溶液 12 mL×1支 终止液 12 mL×1支 密封件 3支 |
|
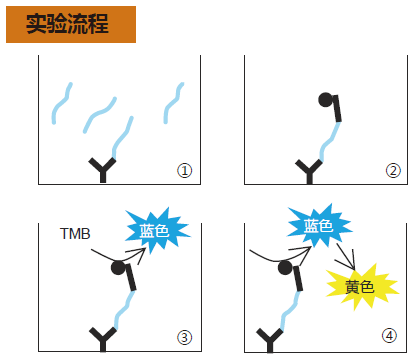
◆实验流程
|
① 加入100 μL 的标准品和样品,在4度冰箱中密封过夜。 ↓ ② 加入 HRP 标记的抗体溶液,在4度冰箱中孵育。 ↓ ③ 加入100 μL TMB 溶液室温孵育 30 分钟,避光,密封盖子,进行显色反应。 ↓ ④ 加入100 μL 终止液,测 OD 450 nm值。 |
 |
◆案例
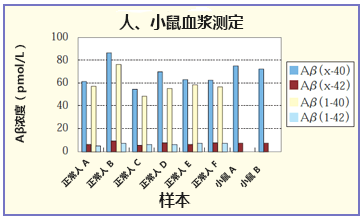
案例1. 人、小鼠血浆的测定
使用 EDTA2K 真空采血管采血,置于 5000 g、4℃、离心15分钟,分离血浆,使用之前存放于-80℃。
用试剂盒附带的标准稀释液,4倍样本稀释后测定。
(*Aβ(1-40)以及Aβ(x-40)的测定使用人β淀粉样蛋白(1-40)ELISA试剂盒 WakoⅡ(产品编号:298-64601)以及人/大鼠β淀粉样蛋白(40)ELISA试剂盒 WakoⅡ(产品编号:294-64701)。
案例2. 小鼠脑组织的测定
用 2 mL 的 Tris 盐水提取12月龄 APP 转基因小鼠(J20)的脑半球,使用之前置于-20℃保存。
用试剂盒附带的标准稀释液,2倍样本稀释后测定。
除了转基因(tg)小鼠,也可测定野生型(wt)小鼠的微量 Aβ 。
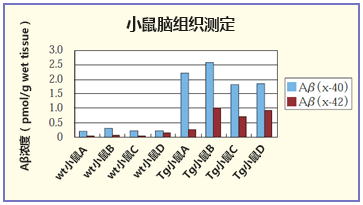
(数据提供:东京大学大学院药学研究科 临床药学教室 岩坪教授 桥本助手)
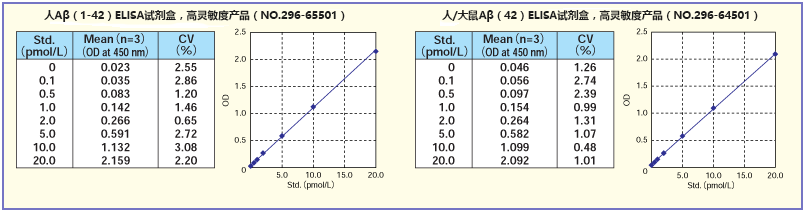
标准曲线
用试剂盒附带的标准溶液制作标准曲线。结果显示,在 0.1~20.0(pmol/L)范围内,接近于直线。
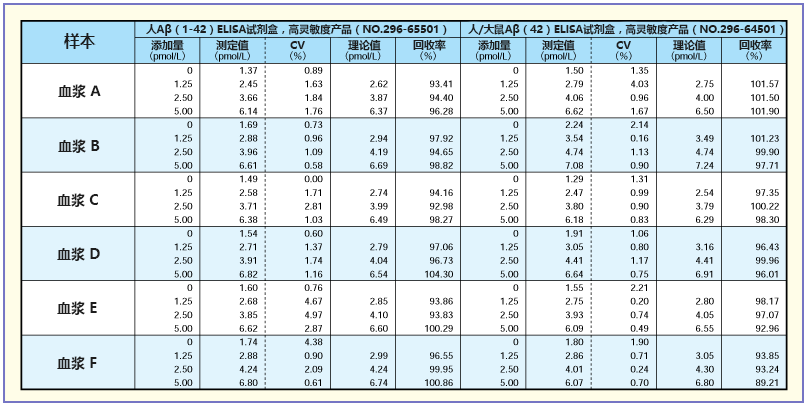
加标回收测试
向血浆中分别加入5、10、20(pmol/L),4倍稀释后记录测定时的回收率(%)(测定值/理论值)。基本显示较高的回收率。
稀释实验
将A、C、E的正常人血浆稀释2~16 倍后求稀释曲线。结果显示,特别是人/大鼠系列获得了良好的稀释曲线。
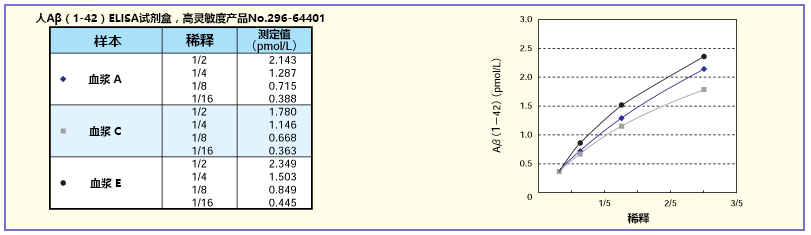
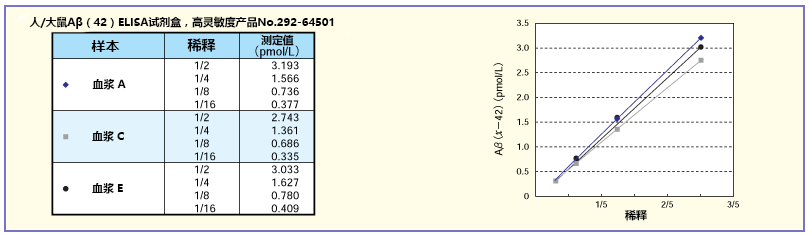
◆Aβ相关ELISA试剂盒选择指南
|
产品编号 |
产品名称 |
抗体克隆编号 |
可检测的Aβ |
检测范围 |
||||||||
|
捕获 |
检测 |
人Aβ |
人Aβ |
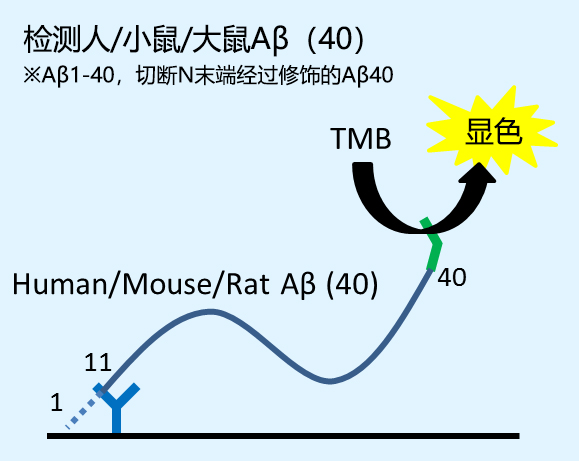
大鼠 (小鼠) Aβ(1-40) |
大鼠 |
Aβ (x-40)※1 |
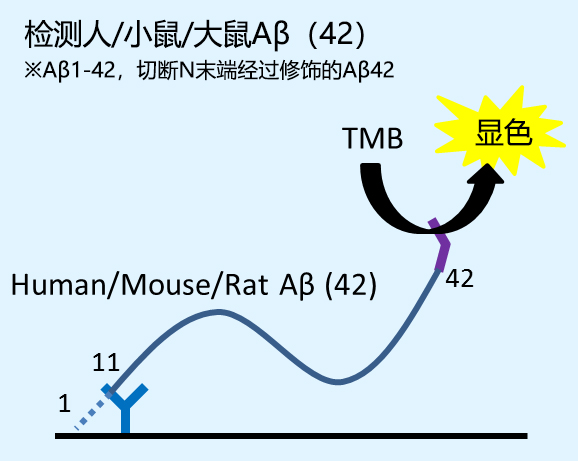
Aβ (x-42)※1 |
人Aβ (≦8 mer) |
人Aβ (≧9 mer) |
1.0-100 |
||
|
292-62301 |
人β淀粉样蛋白(1-40)ELISA 试剂盒 Wako |
BAN50 |
BA27(Fab') |
+ |
– |
– |
– |
– |
– |
※4 |
※4 |
1.0-100 |
|
298-64601 |
人β淀粉样蛋白(1-40)ELISA 试剂盒 Wako II※2 |
BAN50 |
BA27(F[ab']2) |
+ |
– |
– |
– |
– |
– |
※4 |
※4 |
1.0-100 |
|
298-62401 |
人β淀粉样蛋白(1-42)ELISA 试剂盒 Wako |
BAN50 |
BC05(Fab') |
– |
+ |
– |
– |
– |
– |
※4 |
※4 |
1.0 – 100 |
|
296-64401 |
人β淀粉样蛋白(1-42)ELISA 试剂盒Wako,高灵敏度 |
BAN50 |
BC05(Fab') |
– |
+ |
– |
– |
– |
– |
※4 |
※4 |
0.1- 20 |
|
294-62501 |
人/鼠β淀粉样蛋白(40)ELISA 试剂盒Wako |
BNT77 |
BA27(Fab') |
+ |
– |
+ |
– |
+ |
– |
※4 |
※4 |
1.0 – 100 |
|
294-64701 |
人/鼠β淀粉样蛋白(40)ELISA 试剂盒Wako II※3 |
BNT77 |
BA27(F[ab']2) |
+ |
– |
+ |
– |
+ |
– |
※4 |
※4 |
1.0 – 100 |
|
290-62601 |
人/鼠β淀粉样蛋白(42)ELISA 试剂盒 Wako |
BNT77 |
BC05(Fab') |
– |
+ |
– |
+ |
– |
+ |
※4 |
※4 |
1.0 – 100 |
|
292-64501 |
人/鼠β淀粉样蛋白(42)ELISA试剂盒Wako,高灵敏度 |
BNT77 |
BC05(Fab') |
– |
+ |
– |
+ |
– |
+ |
※4 |
※4 |
0.1 – 20 |
|
290-82001 |
高分子β淀粉样蛋白寡聚体 ELISA试剂盒Wako Ver.2 |
BAN50 |
BAN50 |
– |
– |
– |
– |
– |
– |
– |
+ |
0.16-40 |
※1 Aβ(x-40)、Aβ(x-42)为N末端被切断或修饰的Aβ肽。
※2 与292-62301比较抗原抗体反应相对稳定
※3 与294-62501比较抗原抗体反应相对稳定
※4 未验证
※5 换算为MAP16肽
◆适用样品
|
产品编号 |
产品名称 |
脑脊液 |
脑组织提取液 |
血清 |
血浆 |
细胞培养上清 |
|
292-62301 |
人β淀粉样蛋白(1-40)ELISA试剂盒Wako |
+ |
+ |
+ |
+ |
+ |
|
298-64601 |
人β淀粉样蛋白(1-40)ELISA试剂盒Wako II※2 |
+ |
+ |
+ |
+ |
+ |
|
298-62401 |
人β淀粉样蛋白(1-42)ELISA试剂盒Wako |
+ |
+ |
+※6 |
+ |
+ |
|
296-64401 |
人β淀粉样蛋白(1-42)ELISA试剂盒Wako,高灵敏度 |
+ |
+ |
+※6 |
+ |
+ |
|
294-62501 |
人/鼠β淀粉样蛋白(40)ELISA试剂盒Wako |
+ |
+ |
+ |
+ |
+ |
|
294-64701 |
人/鼠β淀粉样蛋白(40)ELISA试剂盒Wako II※3 |
+ |
+ |
+ |
+ |
+ |
|
290-62601 |
人/鼠β淀粉样蛋白(42)ELISA试剂盒Wako |
+ |
+ |
+※6 |
+ |
+ |
|
292-64501 |
人/鼠β淀粉样蛋白(42)ELISA试剂盒Wako,高灵敏度 |
+ |
+ |
+※6 |
+ |
+ |
|
290-82001 |
高分子β淀粉样蛋白寡聚体ELISA试剂盒Wako Ver.2 |
+ |
+ |
+ |
+ |
※4 |
※2 与292-62301比较抗原抗体反应相对稳定
※3 与294-62501比较抗原抗体反应相对稳定
※4 未验证
※6 可检测,但与血浆相比检测数值容易随时间降低
※ 本页面产品仅供研究用。研究以外不可使用。
常见问题
Q1:标准品溶液的OD值过低,导致无法绘制校准曲线。这是如何发生的?
A1:有可能是实际洗板时间过长。尝试在2-3分钟内完成洗板操作。请在室温下使用清洗液。如果无法使用洗板机,首先轻轻地倒出孔内的溶
液(注意避免孔间交叉污染),使用洗瓶等向孔内加入清洗液,随后再次去除清洗液。重复该操作5次。在此种情况下,清洗的总时间也
不要超过2-3分钟。
Q2:标准溶液中的Aβ肽是否会聚集?
A2:标准溶液中的多肽不会聚集。可在冰箱内稳定保存。
Q3:测量值不一致。可能的原因?
A3:在清洗过程中,不同孔之间浸泡的时间(例如加入清洗液的用时)不同可能会导致结果不一致。使用移液器清洗的手动操作特别容易造成时间
偏差。为了确保每孔的浸泡时间尽可能接近,可以尝试这种方式进行清洗操作,如第一次清洗时,从孔板的右侧开始,第二次清洗时从左侧开
始。
Q4:保存方法
A4:人体样品,如脑组织和脑脊液请冷冻保存在冰箱中,但某些样品在此条件下保存后会发生测量值降低的情况。如果Aβ的浓度过低,则应当避
免反复冻融样品。对于细胞培养上清,加入 0.2% 牛血清白蛋白和 0.075% CHAPS(浓度为两者的终浓度)可以降低对容器壁的吸附从而减
少损失,再放入冰箱冷冻保存。
Q5:可以测量血清样品吗?
A5:可行。但不建议这样做,因为血清的测量值通常低于同时采血的血浆的测量值。血清样品冷藏保存时也容易导致更大程度的数值变化。
Q6:对于血浆样品使用何种抗凝剂?
A6:我们推荐 EDTA2K。EDTA2Na 和肝素也可使用。
Q7:除了所示浓度之外,可以将标准品稀释成其他浓度吗?
A7:没有问题。可以根据实验体系,制备一系列适合您的稀释浓度。
Q8:是否可以使用除对数以外的其他类型校准曲线?
A8:没有问题。
Q9:建议样品进行复孔(n=2)测定,标准品是否也有必要进行复孔测定?
A9:建议标准品也进行复孔(n=2)测定,但如果检测样品较多,请根据实验需求进行安排,如n=1。
Q10:开封后的试剂应当如何保存?
A10:将微孔板放回铝箔袋内并放入干燥剂,可以冷藏在冰箱内稳定保存。
各产品的参考文献引用情况:
1. 产品编号:298-64601 产品名称:Human β Amyloid(1-40)ELISA Kit Wako Ⅱ
|
(1) |
Wan W, Zhang C, Danielsen M, et al. EGb761 improves cognitive function and regulates inflammatory responses in the APP/PS1 mouse[J]. Experimental gerontology, 2016, 81: 92-100.<链接> |
|
(2) |
Katsuda T, Oki K, Ochiya T. Potential application of extracellular vesicles of human adipose tissue-derived mesenchymal stem cells in Alzheimer's disease therapeutics[M]//Stem Cell Renewal and Cell-Cell Communication. Humana Press, New York, NY, 2014: 171-181.<链接> |
|
(3) |
Richens J L, Vere K A, Light R A, et al. Practical detection of a definitive biomarker panel for Alzheimer's disease; comparisons between matched plasma and cerebrospinal fluid[J]. International journal of molecular epidemiology and genetics, 2014, 5(2): 53.<链接> |
2. 产品编号:296-64401 产品名称:Human β Amyloid(1-42) ELISA Kit Wako, High Sensitive
|
(1) |
Richens J L, Spencer H L, Butler M, et al. Rationalising the role of Keratin 9 as a biomarker for Alzheimer's disease[J]. Scientific reports, 2016, 6.<链接> |
|
(2) |
Xie Z, McAuliffe S, Swain C A, et al. Cerebrospinal fluid aβ to tau ratio and postoperative cognitive change[J]. Annals of surgery, 2013, 258(2).<链接> |
|
(3) |
Richens J L, Vere K A, Light R A, et al. Practical detection of a definitive biomarker panel for Alzheimer's disease; comparisons between matched plasma and cerebrospinal fluid[J]. International journal of molecular epidemiology and genetics, 2014, 5(2): 53.<链接> |
|
(4) |
Kim M Y, Kim K N, Cho H M, et al. Reference Intervals for Plasma Amyloid β in Korean Adults Without Cognitive Impairment[J]. Annals of laboratory medicine, 2016, 36(6): 595-598.<链接> |
|
(5) |
Zhou L, Chan K H, Chu L W, et al. Plasma amyloid-β oligomers level is a biomarker for Alzheimer's disease diagnosis[J]. Biochemical and biophysical research communications, 2012, 423(4): 697-702.<链接> |
3. 产品编号:292-62301 产品名称:Human β Amyloid(1-40) ELISA Kit Wako
|
(1) |
Bourdenx M, Dovero S, Thiolat M L, et al. Lack of spontaneous age-related brain pathology in Octodon degus: a reappraisal of the model[J]. Scientific Reports, 2017, 7.<链接> |
|
(2) |
Waragai M, Moriya M, Nojo T. Decreased N-Acetyl Aspartate/Myo-Inositol Ratio in the Posterior Cingulate Cortex Shown by Magnetic Resonance Spectroscopy May Be One of the Risk Markers of Preclinical Alzheimer's Disease: A 7-Year Follow-Up Study[J]. Journal of Alzheimer's Disease, 2017 (Preprint): 1-17.<链接> |
|
(3) |
Waragai M, Hata S, Suzuki T, et al. Utility of SPM8 plus DARTEL (VSRAD) combined with magnetic resonance spectroscopy as adjunct techniques for screening and predicting dementia due to Alzheimer's disease in clinical practice[J]. Journal of Alzheimer's Disease, 2014, 41(4): 1207-1222.<链接> |
4. 产品编号:298-62401 产品名称:Human β Amyloid(1-42) ELISA Kit Wako
|
(1) |
Waragai M, Moriya M, Nojo T. Decreased N-Acetyl Aspartate/Myo-Inositol Ratio in the Posterior Cingulate Cortex Shown by Magnetic Resonance Spectroscopy May Be One of the Risk Markers of Preclinical Alzheimer's Disease: A 7-Year Follow-Up Study[J]. Journal of Alzheimer's Disease, 2017 (Preprint): 1-17.<链接> |
|
(2) |
Brubaker W D, Crane A, Johansson J U, et al. Peripheral complement interactions with amyloid β peptide: Erythrocyte clearance mechanisms[J]. Alzheimer's & Dementia, 2017.<链接> |
|
(3) |
Crane A, Brubaker W D, Johansson J U, et al. Peripheral complement interactions with amyloid β peptide in Alzheimer's disease: 2. Relationship to Aβ immunotherapy[J]. Alzheimer's & Dementia, 2017.<链接> |
更多参考文献,请点击此处查看
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 292-62301 | Human β Amyloid(1-40) ELISA Kit Wako 人β 淀粉样蛋白(1-40)ELISA试剂盒 Wako |
96 tests | for Immunochemistry | – |
| 298-62401 | Human β Amyloid(1-42) ELISA Kit Wako 人 β淀粉样蛋白(1-42)ELISA试剂盒 Wako |
96 tests | for Immunochemistry | – |
| 296-64401 | Human β Amyloid(1-42) ELISA Kit Wako, High Sensitive 人 β淀粉样蛋白(1-42)ELISA试剂盒 Wako ,高灵敏度 |
96 tests | for Immunochemistry | – |
| 298-64601 | Human β Amyloid(1-40)ELISA Kit Wako Ⅱ 人 β淀粉样蛋白(1-40)ELISA试剂盒Wako II |
96 tests | for Immunochemistry | – |
| 294-62501 | Human/Rat β Amyloid(40)ELISA Kit Wako 人/ β淀粉样蛋白(40)ELISA试剂盒 Wako |
96 tests | for Immunochemistry | – |
| 290-62601 | Human/Rat β Amyloid(42)ELISA Kit Wako 人/鼠β淀粉样蛋白(42)ELISA试剂盒 Wako |
96 tests | for Immunochemistry | – |
| 292-64501 | Human/Rat β Amyloid(42) ELISA Kit Wako, High Sensitive 人/鼠β淀粉样蛋白(42)ELISA试剂盒 Wako ,高灵敏度 |
96 tests | for Immunochemistry | – |
| 294-64701 | Human/Rat β Amyloid(40) ELISA Kit Wako II 人/鼠β淀粉样蛋白(40)ELISA试剂盒Wako II |
96 tests | for Immunochemistry | – |
| 290-82001 | High Molecular Amyloid β Oligomer ELISA Kit Wako Ver.2 高分子β淀粉样蛋白寡聚体ELISA试剂盒Wako Ver.2 |
96 tests | for Immunochemistry |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
食欲素 A ELISA 试剂盒
食欲素 A ELISA 试剂盒
- 产品特性
- 相关资料
- Q&A
- 参考文献

食欲素 A ELISA 试剂盒
食欲素是一种神经肽,分为A和B两种类型。在患有睡眠障碍的发作性睡病患者的脑脊髓液中发现食欲素A显著降低,因此食欲素A被认为在睡眠中起到至关重要的作用。食欲素A的检测常用放射免疫分析法,但由于此方法需要使用放射性同位素(RI),因此能够进行检测的研究机构有限。
本产品为无需使用RI即可轻松检测人脑脊液以及大鼠脑脊髓液、血清、血浆中的食欲素A的ELISA试剂盒。不会与食欲素 B 交叉反应。
◆特点
● 无需RI
● 高灵敏度 (4.69-300 pg/mL)
● 所需样品量少 (25 μL)
性能
| 标准曲线范围 | 4.69~300 pg/mL |
| 检测对象样品 | 人脑脊液、大鼠脑脊液、大鼠血浆、大鼠血清※1 |
| 所需样品量 | 25 μL |
| 检测时间 | 约20 h |
| 同时再现性 | CV<5% |
| 日间再现性 | CV<16% |
※1:正常人血浆及血清、野生型小鼠血浆及血清中所含的食欲素A浓度非常低,低于本试剂盒的检测灵敏度。但在添加和过表达系统中或许可以检测出食欲素A。
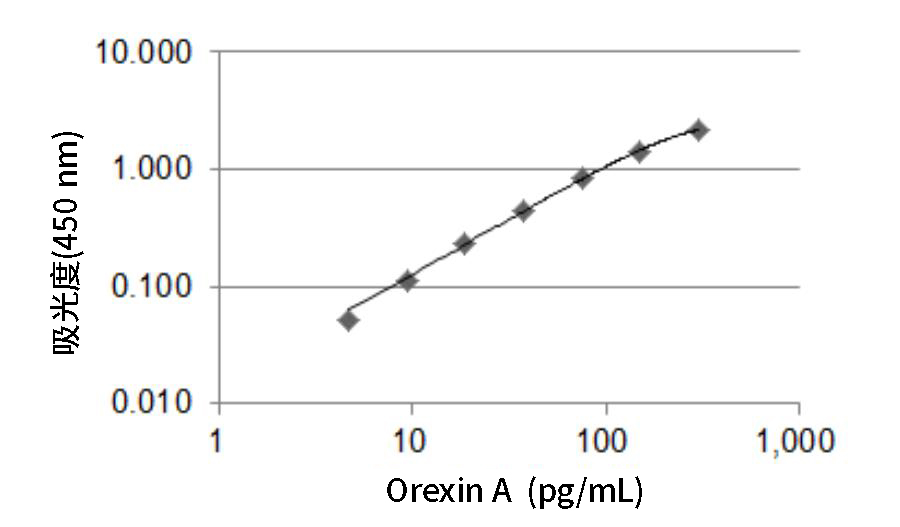
标准曲线
检测示例
■ 加标回收测试
| 未添加 | 添加5 pg/mL食欲素A | 添加20 pg/mL食欲素A | 添加100 pg/mL食欲素A | ||||
| 检测值 (pg/mL) | 检测值 (pg/mL) | Recovery | 检测值 (pg/mL) | Recovery | 检测值 (pg/mL) | Recovery | |
| 大鼠脑脊液① | 51.82 | 54.96 | 96.70% | 63.74 | 88.80% | 120.77 | 79.60% |
| 大鼠脑脊液② | 47.69 | 55.55 | 105.40% | 63.4 | 93.70% | 109.95 | 74.50% |
| 大鼠脑脊液③ | 38.05 | 43.99 | 102.20% | 59.12 | 101.80% | 101.16 | 73.30% |
| 人脑脊液① | 12.25 | 14.29 | 82.80% | 23.25 | 72.10% | 65.16 | 58.10% |
| 人脑脊液② | 47.21 | 50.45 | 96.60% | 55.71 | 82.90% | 107.12 | 72.80% |
| 人脑脊液③ | 24.41 | 25.99 | 88.40% | 35.07 | 79.00% | 83.51 | 67.10% |
| 大鼠血清① | Not detected | 5.64 | 112.80% | 19.94 | 99.70% | 89.58 | 89.60% |
| 大鼠血清② | 6.42 | 12.26 | 107.40% | 25.05 | 94.80% | 93.6 | 88.00% |
| 大鼠血浆① | 1.45 | 6.81 | 105.60% | 20.3 | 94.60% | 91.13 | 89.80% |
| 大鼠血浆② | 2.28 | 7.2 | 98.90% | 21.64 | 97.10% | 90.51 | 88.50% |
结果显示,从人和大鼠样品中获得了高定量性的检测数据。
本产品引用文献:
Ono, T., et al.: Psychiatry Clin Neurosci. 72, 11, 849 (2018).
◆推荐产品
YNT-185 · 2HCl 非肽型食欲素-2 受体激动剂
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 293-79801 | Orexin A ELISA Kit Wako 食欲素A ELISA试剂盒 |
96 Tests | 免疫化学用 | – |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 254-00641 | YNT-185 Dihydrochloride Hydrate YNT-185盐酸水合物 |
5 mg | 细胞生物学用 | – |
| 250-00643 | YNT-185 Dihydrochloride Hydrate YNT-185盐酸水合物 |
10 mg | 细胞生物学用 | – |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 156-03171 | Orexin B (Human) 食欲素B(人) |
0.1 mg | 细胞生物学用 | – |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
LBIS® 胰高血糖素样肽-1(GLP-1)(活性) ELISA试剂盒 LBIS® GLP-1(active) ELISA KIT
LBIS® 胰高血糖素样肽-1(GLP-1)(活性) ELISA试剂盒
LBIS® GLP-1(active) ELISA KIT
- 产品特性
- 相关资料
- Q&A
- 参考文献
LBIS® GLP-1(active) ELISA KIT![]()
LBIS® 胰高血糖素样肽-1(GLP-1)(活性) ELISA 试剂盒
胰高血糖素样肽-1(Glucagon-like peptide-1,GLP-1)是胰高血糖素前驱体的一部分。胰高血糖素前驱体于胰脏、小肠下部以及下丘脑中表达。该前驱体的构造中含有与糖代谢有关的各种各样的生理活性物质(胰高血糖素,肠高血糖素,胃泌酸调节素,GLP-1,GLP-2)的氨基酸序列。根据表达部位加工酶的特异性,胰脏主要分泌胰高血糖素,而小肠下部主要分泌肠高血糖素和胃泌酸调节素。GLP-1 和 GLP-2 则存在于胰高血糖素前驱体后半的结构中。GLP-1由37个氨基酸组成,有2种生物活性形式,分别为 GLP-1(7-37)和GLP-1(7-36)酰胺。两者都存在于小肠下部、胰脏和下丘脑中,GLP-1(7-36)酰胺在下丘脑中占免疫反应 GLP-1(IR-GLP-1)总量的 55-94%,在小肠中占 27-73%。但在胰脏中只有极少量存在。大部分哺乳类(如人类、大鼠、小鼠、牛、猪、狗等)的 GLP-1 结构相似。
GLP-1: hdeferhaegtftsdvssylegqaakefiawlvkgrg
GLP 1(7-37): haegtftsdvssylegqaakefiawlvkgrg
GLP 1(7-36) amide: haegtftsdvssylegqaakefiawlvkgr-NH2
GLP-1 与小肠上部分泌的 GIP 统称为肠促胰素。该类激素是葡萄糖浓度依赖性方式促进胰岛素分泌。同时具有抑制胃肠道蠕动和胃液分泌、抑制胰高血糖素的释放、促进生长抑素的分泌、使食欲减退,促进肠上皮细胞生长、以及外周组织促进非胰岛素依赖性的葡萄糖的消耗,并促进细胞的生长的作用。有报告指出该类激素与垂体激素的分泌也有关系。
GLP-1(7-36)酰胺在生物体内代谢迅速,DPP-IV(dipeptidyl peptidase IV)会使其失去N-末端的两个氨基酸变为 GLP-1(9-36)酰胺,GLP-1(7-37)变为 GLP-1(9-37)后会失去活性。有报告指出,体外实验中,在犬的血浆中 GLP-1(7-36)酰胺的半衰期是为 61±9 分,GLP-1(7-37)为 132±16 分。因此 GLP-1 的测定,取样的时候有必要使用 DPP-IV 抑制剂。
此外,肠促胰素中的 GIP 则是有力促进 GLP-1 分泌的激素。回肠中 GLP-1 的分泌不是食物直接刺激肠道而产生的,而是由于胆碱能和肽类的刺激所产生的。
◆特点
● 短时间测定(完全反应时间:5小时)
● 微量样品(标准操作用量:10 μL)可测
● 使用对环境无害的防腐剂
● 全部试剂均为液体,可直接使用
● 精密的测定精度和高再现性
◆构成
|
组成 |
状态 |
容量 |
|
(A) 抗体固相化 96 孔板 |
洗净后使用 |
96 wells(8×12)/1 块 |
|
(B) GLP-1标准溶液(500 pg/mL) |
稀释后使用 |
200 μL/1 瓶 |
|
(C) 缓冲液 |
即用 |
60 mL/1 瓶 |
|
(D)生物素结合抗GLP-1抗体 |
稀释后使用 |
100 μL/1 瓶 |
|
(E) 过氧化物・抗生物素蛋白结合物 |
稀释后使用 |
100 μL/1 瓶 |
|
(F) 显色液(TMB) |
即用 |
12 mL/1 瓶 |
|
(H) 反应终止液(1M H2SO4)※小心轻放 |
即用 |
12 mL/1 瓶 |
|
( I ) 浓缩洗净液(10×) |
稀释后使用 |
100 mL/1 瓶 |
|
封板膜 |
4 张 |
|
|
使用说明书 |
1 份 |
◆交叉反应
※交差率是 1,000 pg/mL 浓度时的数据
|
动物类型 |
对象物质 |
反应性和反应率(%) |
|
Mouse/Rat |
GLP-1(7-36)amide |
100 |
|
GLP-1(7-37) |
< 0.1 |
|
|
GLP-1(1-37) |
― |
|
|
GLP-1(9-36)amide |
― |
|
|
GLP-2 |
― |
|
|
Glucagon(1-29) |
― |
|
|
Insulin |
― |
|
|
Secretin |
― |
|
|
GIP |
― |
|
|
VIP |
― |
|
|
GRF |
― |
|
|
Bovine |
Glucagon(1-29) |
― |
|
VIP |
― |
|
|
Porcine |
Glucagon(1-29) |
― |
|
VIP |
― |
―:不存在交叉反应
◆样品信息
小鼠和大鼠的血清及血浆
10 μL/well(标准操作方法)
※测量中由于酶(DPP-IV 等)的影响,采血时请注意防止 GLP-1(7-36)酰胺的分解,再使用。
◆测定范围
1.56~50.0 pg/mL 【0.47~15.16 pmol/L(分子量3298)】(标准曲线范围)
7.8~250 pg/mL(样品量 10 μL)
3.9~125 pg/mL(样品量 20 μL)
◆Validation data
精度测试(组内变异)
|
样品 |
A |
B |
|
1 |
23.7 |
6.44 |
|
2 |
23.2 |
5.97 |
|
3 |
23.4 |
6.39 |
|
4 |
24.0 |
5.87 |
|
5 |
24.1 |
6.44 |
|
mean |
23.7 |
6.22 |
|
SD |
0.35 |
0.28 |
|
CV(%) |
1.5 |
4.5 |
单位:pg/mL
重复性测试(组间变异)
|
测量日/样品 |
E |
F |
|
第0天 |
25.1 |
6.31 |
|
第1天 |
25.1 |
6.16 |
|
第2天 |
25.0 |
6.24 |
|
第3天 |
25.0 |
6.37 |
|
mean |
25.0 |
6.27 |
|
SD |
0.03 |
0.09 |
|
CV(%) |
0.13 |
1.4 |
单位:pg/mL n=4
加标回收测试
样品C
|
添加量 |
实测值 |
回收量 |
回收率(%) |
|
0.00 |
3.93 |
– |
– |
|
3.26 |
7.28 |
3.35 |
103 |
|
6.51 |
10.3 |
6.37 |
97.8 |
|
8.14 |
12.1 |
8.17 |
100 |
样品D
|
添加量 |
实测值 |
回收量 |
回收率(%) |
|
0.00 |
11.8 |
– |
– |
|
7.16 |
19.1 |
7.30 |
102 |
|
14.3 |
25.5 |
13.7 |
95.8 |
|
21.5 |
32.4 |
20.6 |
95.8 |
稀释直线性测试
用稀释缓冲液分三次连续稀释2个血清样品的结果,直线回归方程的R2在0.997~0.9999之间。
参考文献
|
1. |
Elevated hepatic DPP4 activity promotes insulin resistance and non-alcoholic fatty liver disease. Baumeier C, Schluter L, Saussenthaler S, Laeger T, Rodiger M, Alaze SA, Fritsche L, Haring HU, Stefan N, Fritsche A, Schwenk RW, Schurmann A. Mol Metab. 2017 Oct;6(10):1254-1263. |
|
2. |
Recombinant Mouse Osteocalcin Secreted by Lactococcus lactis Promotes Glucagon-Like Peptide-1 Induction in STC-1 Cells. Namai F, Shigemori S, Sudo K, Sato T, Yamamoto Y, Nigar S, Ogita T, Shimosato T. Curr Microbiol. 2017 Sep 13. |
|
3. |
A proliferative probiotic Bifidobacterium strain in the gut ameliorates progression of metabolic disorders via microbiota modulation and acetate elevation. Aoki R, Kamikado K, Suda W, Takii H, Mikami Y, Suganuma N, Hattori M, Koga Y. Sci Rep. 2017 Mar 2;7:43522. |
|
4. |
Effect of miglitol on the suppression of nonalcoholic steatohepatitis development and improvement of the gut environment in a rodent model. Kishida Y, Okubo H, Ohno H, Oki K, Yoneda M. J Gastroenterol. 2017 Mar 27. |
|
5. |
Fermented vegetable and fruit extract (OM-XŪ) stimulates murine gastrointestinal tract cells and RAW264. 7 cells in vitro and regulates liver gene expression in vivo. Wakame K, Nakata A, Sato K, Mihara Y, Takahata M, Miyake Y, Okada M, Shimomiya Y, and Komatsu K. Integr Mol Med, 2017 http://www.omx.co.jp/files/attachments/8e3f7824b69bece18acca14baf314b11.PDF
|
|
6. |
Gut commensal Bacteroides acidifaciens prevents obesity and improves insulin sensitivity in mice. Yang JY, Lee YS, Kim Y, Lee SH, Ryu S, Fukuda S, Hase K, Yang CS, Lim HS, Kim MS, Kim HM, Ahn SH, Kwon BE, Ko HJ, Kweon MN. Mucosal Immunol. 2017 Jan;10(1):104-116 |
|
7. |
An extract from pork bones containing osteocalcin improves glucose metabolism in mice by oral administration. Mizokami A, Wang D, Tanaka M, Gao J, Takeuchi H, Matsui T, Hirata M. Biosci Biotechnol Biochem. 2016 Jul 27:1-8. |
|
8. |
Catecholamines Facilitate Fuel Expenditure and Protect Against Obesity via a Novel Network of the Gut-Brain Axis in Transcription Factor Skn-1-deficient Mice. Ushiama S, Ishimaru Y, Narukawa M, Yoshioka M, Kozuka C, Watanabe N, Tsunoda M, Osakabe N, Asakura T, Masuzaki H, Abe K. EBioMedicine. 2016 Jun;8:60-71. |
|
9. |
Dipeptidyl peptidase 4 inhibitor reduces intimal hyperplasia in rabbit autologous jugular vein graft under poor distal runoff. Koyama A, Komori K, Otsuka R, Kajikuri J, Itoh T. J Vasc Surg. 2016 May;63(5):1360-70. |
|
10. |
Dipeptidyl peptidase-4 inhibitor, linagliptin, ameliorates endothelial dysfunction and atherogenesis in normoglycemic apolipoprotein-E deficient mice. Salim HM, Fukuda D, Higashikuni Y, Tanaka K, Hirata Y, Yagi S, Soeki T, Shimabukuro M, Sata M. Vascul Pharmacol. 2016 Apr;79:16-23. |
|
11. |
Intestinal Bile Acid Composition Modulates Prohormone Convertase 1/3 (PC1/3) Expression and Consequent GLP-1 Production in Male Mice. Morimoto K, Watanabe M, Sugizaki T, Irie J, Itoh H. Endocrinology. 2016 Mar;157(3):1071-81. |
|
12. |
Total gastrectomy-induced reductions in food intake and weight are counteracted by rikkunshito by attenuating glucagon-like peptide-1 elevation in rats. Taguchi M, Dezaki K, Koizumi M, Kurashina K, Hosoya Y, Lefor AK, Sata N, Yada T. Surgery. 2016 Jan 13. pii: S0039-6060(15)01029-6 |
|
13. |
DPP-4 inhibition has beneficial effects on the heart after myocardial infarction. Akihiko Kubota, Hiroyuki Takano, Haixiu Wang, Hiroshi Hasegawa, Hiroyuki Tadokoro, Masanori Hirose, Yuka Kobaraa, Tomoko Yamada-Inagawa, Issei Komuro, Yoshio Kobayashi. Journal of Molecular and Cellular Cardiology, Volume 91, Feb. 2016, Pages 72–80 |
|
14. |
The dipeptidyl peptidase IV inhibitor vildagliptin suppresses development of neuropathy in diabetic rodents: Effects on peripheral sensory nerve function, structure and molecular changes. Tsuboi K, Mizukami H, Inaba W, Baba M, Yagihashi S. J Neurochem. Volume 136, Issue 4, pages 859–870, Feb. 2016 |
|
15. |
Intestinal Bile Acid Composition Modulates Prohormone Convertase 1/3 (PC1/3) Expression and Consequent GLP-1 Production in male mice. Morimoto K, Watanabe M, Sugizaki T, Irie JI, Itoh H. Endocrinology. 2016 Jan 20:en20151551. |
|
16. |
Hypoxia decreases glucagon-like peptide-1 secretion from the GLUTag cell line. Kihira Y, Burentogtokh A, Itoh M, Izawa-Ishizawa Y, Ishizawa K, Ikeda Y, Tsuchiya K, Tamaki T. Biol Pharm Bull. Vol.38(4), p514-21, 2015. |
|
17. |
Dietary obacunone supplementation stimulates muscle hypertrophy, and suppresses hyperglycemia and obesity through the TGR5 and PPARγ pathway. Horiba T, Katsukawa M, Mita M, Sato R. Biochem Biophys Res Commun. Vol.463(4), p846-52, Aug 2015. |
|
18. |
Combination of DPP-4 inhibitor and PPARγ agonist exerts protective effects on pancreatic β-cells in diabetic db/db mice through the augmentation of IRS-2 expression. Hirukawa H, Kaneto H, Shimoda M, Kimura T, Okauchi S, Obata A, Kohara K, Hamamoto S, Tawaramoto K, Hashiramoto M, Kaku K. Mol Cell Endocrinol. Jun 2015. |
|
19. |
Glucagon-like peptide-1 is specifically involved in sweet taste transmission. Takai S, Yasumatsu K, Inoue M, Iwata S, Yoshida R, Shigemura N, Yanagawa Y, Drucker DJ, Margolskee RF, Ninomiya Y. FASEB J. Vol.29(6), p2268-80, Jun 2015. |
|
20. |
Dipeptidyl-peptidase-4 inhibitor, alogliptin, attenuates arterial inflammation and neointimal formation after injury in low-density lipoprotein (LDL) receptor-deficient mice. Akita K, Isoda K, Shimada K, Daida H. J Am Heart Assoc. Vol.13;4(3):e001469, Mar 2015. |
|
21. |
Effects of sleeve gastrectomy and gastric banding on the hypothalamic feeding center in an obese rat model. Kawasaki T1, Ohta M, Kawano Y, Masuda T, Gotoh K, Inomata M, Kitano S. Surg Today. 2015 Feb 28. |
|
22. |
Duodenal-jejunal bypass improves diabetes and liver steatosis via enhanced glucagon-like peptide-1 elicited by bile acids. Kashihara H, Shimada M, Kurita N, Sato H, Yoshikawa K, Higashijima J, Chikakiyo M, Nishi M, Takasu C. J Gastroenterol Hepatol. Vol.30(2), p308-15, Feb 2015. |
|
23. |
Mosapride citrate improves nonalcoholic steatohepatitis with increased fecal lactic acid bacteria and plasma glucagon-like peptide-1 level in a rodent model. Okubo H, Nakatsu Y, Sakoda H, Kushiyama A, Fujishiro M, Fukushima T1, Matsunaga Y, Ohno H, Yoneda M, Kamata H, Shinjo T, Iwashita M, Nishimura F, Asano T. Am J Physiol Gastrointest Liver Physiol. Vol.15;308(2), G151-8, Jan 2015. |
|
24. |
Glucagon-like peptide-1 production in the GLUTag cell line is impaired by free fatty acids via endoplasmic reticulum stress. Hayashi H, Yamada R, Das SS, Sato T, Takahashi A, Hiratsuka M, Hirasawa N. Metabolism. Vol.63(6), p800-11. Jun 2014. |
|
25. |
MK-0626, a selective DPP-4 inhibitor, attenuates hepatic steatosis in ob/ob mice. Ohyama T, Sato K, Yamazaki Y, Hashizume H, Horiguchi N, Kakizaki S, Mori M, Kusano M, Yamada M. World J Gastroenterol.Vol.20(43), p16227-35, Nov 2014. |
|
26. |
Oral administration of osteocalcin improves glucose utilization by stimulating glucagon-like peptide-1 secretion. Mizokami A, Yasutake Y, Higashi S, Kawakubo-Yasukochi T, Chishaki S, Takahashi I, Takeuchi H, Hirata M. Bone. 16;69C:68-79. Sep 2014. |
|
27. |
Dietary sweet potato (Ipomoea batatas L.) leaf extract attenuates hyperglycaemia by enhancing the secretion of glucagon-like peptide-1 (GLP-1) . Nagamine R, Ueno S, Tsubata M, Yamaguchi K, Takagaki K, Hira T, Hara H, Tsuda T. Food Funct, Vol.5(9), p2309-2316, Aug 2014. |
|
28. |
Duodenal-jejunal bypass improves diabetes and liver steatosis via enhanced glucagon-like peptide-1 elicited by bile acids. Kashihara H, Shimada M, Kurita N, Sato H, Yoshikawa K, Higashijima J, Chikakiyo M, Nishi M, Takasu C. Journal of Gastroenterology and Hepatology, Aug 2014. |
|
29. |
Deletion of Hypoxia-Inducible Factor-1α in Adipocytes Enhances Glucagon-Like Peptide-1 Secretion and Reduces Adipose Tissue Inflammation. Kihira Y, Miyake M, Hirata M, Hoshina Y, Kato K, Shirakawa H, Sakaue H, Yamano N, Izawa-Ishizawa Y, Ishizawa K, Ikeda Y, Tsuchiya K, Tamaki T, Tomita S. PLoS One. 2014 Apr 4;9(4):e93856 |
|
30. |
Glucagon-like peptide-1 production in the GLUTag cell line is impaired by free fatty acids via endoplasmic reticulum stress. Hayashi H., Yamada R., Shankar Das S., Sato T., Takahashi A., Hiratsuka M., Hirasawa N. Metabolism – Clinical and Experimental, 2014. |
|
31. |
Dipeptidyl peptidase-4 inhibitor ameliorates early renal injury through its anti-inflammatory action in a rat model of type 1 diabetes. Kodera AR, Shikata K., Takatsuka T., Oda K., Miyamoto S., Kajitani N., Hirota D., Ono T., Usui HK., Makino H. Biochemical and Biophysical Research Communications, Vol.443(3), p828-833, Jan 2014. |
|
32. |
Novel insight into the distribution of L-cells in the rat intestinal tract. Hansen CF., Vrang N., Sangild PT., Jelsing J. Am J Transl Res, Vol.5(3), p347-358, 2013. |
|
33. |
Cinnamtannin A2, a Tetrameric Procyanidin, Increases GLP-1 and Insulin Secretion in Mice. Yamashita Y, Okabe M, Natsume M, Ashida H. Bioscience, Biotechnology, and Biochemistry , Vol.77(4), 2013 |
|
34. |
The protective roles of GLP-1R signaling in diabetic nephropathy:possible mechanism and therapeutic potential. H.Fujita, T.Morii, H.Fujishima, T.Sato, T.Shimizu, M.Hosoba, K.Tsukiyama, T.Narita, T.Takahashi, D.J.Drucker, Y.Seino, and Y.Yamada. Kidney International, 2013 |
|
35. |
Beneficial effects of vildagliptin combined with miglitol on glucose tolerance and islet morphology in diet-controlled db/db mice. K.Ishibashi., A.Hara., Y.Fujitani., T.Uchida., K.Komiya., M.Tamaki., H.Abe., T.Ogihara., A.Kanazawa., R.Kawamori and H.Watada. Biochem Biophys Res Commun, Vol.440(4), p570-575, Nov 2013. |
|
36. |
Vildagliptin preserves the mass and function of pancreatic β cells via the developmental regulation and suppression of oxidative and endoplasmic reticulum stress in a mouse model of diabetes. Hamamoto S, Kanda Y, Shimoda M, Tatsumi F, Kohara K, Tawaramoto K, Hashiramoto M and Kaku K. Diabetes, Obesity and Metabolism,Vol.15(2), p153-163, Feb 2013. |
|
37. |
Osteocalcin Induces Release of Glucagon-Like Peptide-1 and Thereby Stimulates Insulin Secretion in Mice. Mizokami A, Yasutake Y, Gao J, Matsuda M, Takahashi I, Takeuchi H and Hirata M. PLoS ONE 8(2): e57375. Feb 2013 |
|
38. |
DPP4 inhibitor vildagliptin preserves β-cell mass through amelioration of endoplasmic reticulum stress in C/EBPB transgenic mice. Shinobu Shimizu, Tetsuya Hosooka, Tomokazu Matsuda, Shun-ichiro Asahara, Maki Koyanagi-Kimura, Ayumi Kanno, Alberto Bartolome, Hiroaki Etoh, Megumi Fuchita, Kyoko Teruyama, Hiroaki Takahashi, Hiroyuki Inoue, Yusuke Mieda, Naoko Hashimoto, Susumu Seino, and Yoshiaki Kido. J Mol Endocrinol, Vol.49, p125-135, Oct 2012. |
|
39. |
Effects of long-term treatment with the dipeptidyl peptidase-4 inhibitor vildagliptin on islet endocrine cells in non-obese type 2 diabetic Goto-Kakizaki rats. Inaba W, Mizukami H, Kamata K, Takahashi K, Tsuboi K and Yagihashi S. European Journal of Pharmacology,Vol.691(1-3), p297-306, Sep 2012. |
|
40. |
The DPP4 inhibitor linagliptin delays the onset of diabetes and preserves β-cell mass in non-obese diabetic mice. Jacob Jelsing, Niels Vrang, Soren B van Witteloostuijn, Michael Mark and Thomas Klein. J Endocrinol, Vol.214, p381-387, Sep 2012. |
|
41. |
Neural and humoral changes associated with the adjustable gastric band: insights from a rodent model. J Kampe, A Stefanidis, S H Lockie, W A Brown, J B Dixon, A Odoi, S J Spencer, J Raven and B J Oldfield. International Journal of Obesity, 27 Mar 2012. |
|
42. |
Neural and humoral changes associated with the adjustable gastric band: insights from a rodent model. J Kampe, A Stefanidis, S H Lockie, W A Brown, J B Dixon, A Odoi, S J Spencer, J Raven and B J Oldfield. International Journal of Obesity, 27 Mar 2012. |
|
43. |
Mate Tea(Ilex paraguariensis)Promotes Satiety and Body Weight Lowering in Mice:Involvement of Glucagon-Like Peptide-1. G, M, E, Hussein., H, Matsuda., S, Nakamura., M, Hamao., T, Akiyama., K, Tamura., and M, Yoshikawa. Biol.Pharm.Bull. Vol.34(12), p1849-1855, 2011. |
|
44. |
5-Hydroxy-eicosapentaenoic acid is an endogenous GPR119 agonist and enhances glucose-dependent insulin secretion. R, Kogure., K, Toyama., S, Hiyamuta., I, Kojima., S, Takeda. Biochemical and Biophysical Research Communications Vol.416(1-2), p58-63, 2011. |
|
45. |
GLP-1 Secretion in Response to Oral and Luminal Palatinose (Isomaltulose) in Rats. T,Hira.,M,Muramatsu.,M,Okuno.and H,Hara. J Nutr Sci Vitaminol, Vol.57, p30-35, 2011. |
|
46. |
Trehalose prevents adipocyte hypertrophy and mitigates insulin resistance. C,Arai.,N,Arai.,A,Mizote.,K,Kohno.,K,Iwaki.,T,Hanaya.,S,Arai.,S,Ushio.,S,Fukuda. Nutrition Research, Vol.30(12), p840-848, 2010. |
|
47. |
Imaging exocytosis of single glucagon-like peptide-1 containing granules in a murine enteroendocrine cell line with total internal reflection fluorescent microscopy. Ohara-Imaizumi,M.,Aoyagi,K.,Akimoto,Y.,Nakamichi,Y.,Nishiwaki,C.,Kawakami,H.and Nagamatsu,S. Biochemical and Biophysical Reseach Communications, Vol.390, p16-20, 2009. |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 637-15129 | (AKMGP-011) LBIS® GLP-1(Active) ELISA Kit LBIS® 胰高血糖素样肽-1(GLP-1)(活性) ELISA试剂盒 |
96 tests | – | – |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
LBIS® 抗dsDNA-小鼠ELISA试剂盒 LBIS® Mouse Anti-dsDNA ELISA Kit
LBIS® 抗dsDNA-小鼠ELISA试剂盒
LBIS® Mouse Anti-dsDNA ELISA Kit
- 产品特性
- 相关资料
- Q&A
- 参考文献
LBIS® 抗dsDNA-小鼠ELISA试剂盒![]()
LBIS® Mouse Anti-dsDNA ELISA Kit
近年来研究人员多通过使用与人具有同样的自身免疫性疾病的实验动物自然发病和人为使实验动物发症的方式来研究自身免疫性疾病的机制阐明和新型药物开发。自然发病系统代表的MRL/lpr小鼠被应用到很多实验。MRL/lpr小鼠在淋巴结肿瘤发病同时伴随着肾炎、血管炎、关节炎的高机率发病,对包含慢性风湿性关节炎(RA)模型的自身免疫性疾病发病机制的阐明,可作为有效的模型进行研究。MRL/lpr小鼠血清中被检测出自身抗体有IgG型类风湿因子(RF)、IgM型类风湿因子(RF)、抗ssDNA 抗体、抗dsDNA 抗体、抗Sm 抗体。
通过使用该疾病动物血清中自身抗体含量做标准曲线,通过单位转换,可进行测量之间数值的比较。
LBIS® 抗dsDNA-小鼠ELISA试剂盒采用了测定小鼠抗dsDNA 抗体浓度的夹心酶联免疫测定法。
此试剂盒仅限研究使用。
◆特点
● 全反应时间是4小时20分钟。
● 测定小鼠血清或者血浆(肝素血浆除外)中的抗dsDNA 抗体浓度。
● 可测定微量样本(标准操作法是5 μL)。
● 1个试剂盒可做96孔。
● 标准品是小鼠源。
● 全部试剂均为液体。
试剂盒的保存和使用期限
试剂盒在2-8℃保存。此保存条件下,有效期(记载在外箱标签)内试剂盒是稳定的。开封的试剂对应保存状态可能会受到影响,请尽早使用。
◆测定原理
本试剂盒是标准品、稀释样本在抗原包被的微孔板中进行孵育处理。孵育2小时后清洗,加入过氧化物酶结合抗小鼠IgG抗体,与捕捉的抗体孵育2小时。清洗后,显色剂(TMB)与孔中残留的过氧化物酶反应。添加酸性溶液可终止反应。反应生成的黄色产物在450 nm处(副波长620 nm)测定。吸光度与抗小鼠dsDNA 抗体浓度成正比。标准品浓度对应吸光度可制作成标准曲线。通过标准曲线获得未知样本浓度。
◆试剂盒组成
|
组成 |
状态 |
包装 |
|
(A)抗原包被96孔板 |
直接使用 |
96 wells((8×12)/个) |
|
(B)标准抗小鼠dsDNA 抗体溶液(10000 mU/mL)※ |
浓缩液 |
100 μL/瓶 |
|
(C)缓冲液 |
直接使用 |
60 mL/瓶 |
|
(D)标记抗体 (过氧化物酶结合抗小鼠IgG抗体) |
浓缩液 |
20 μL/瓶 |
|
(E)显色液(TMB) |
直接使用 |
12 mL/瓶 |
|
(F)终止液(1M H2SO4)※注意操作 |
直接使用 |
12 mL/瓶 |
|
(G)浓缩清洗液(10×) |
浓缩液 |
100 mL/瓶 |
|
盖板 |
1 个 |
|
|
操作说明书 |
1 本 |
※根据批次不同,数值有差异。
◆所需必要设备
● 蒸馏水。
● 标准溶液稀释用试管。
● 清洗液(稀释用溶液)用玻璃器具。(量筒·瓶)
● 枪头交换式移液器。(一次性枪头5 μL正规的移液枪,以及50-450 μL正规的移液枪)
● 连续分装移液枪。(例:Eppendorf 的multipette plus、可进行100 μL连续分装的仪器。)
● 纸巾等吸水性物品。(清洗后去除板上残留液体)
● 搅拌器。(Vortex类型)
● 96孔板用振荡器。(约800 rpm)
● 96孔板用清洗机(若有是最好)或者注射瓶。
● 96孔板酶标仪。(450 ±10 nm 、620 nm:600~650 nm)
● 数据分析用软件。(若有是最好)
◆试剂盒性能
● 测定范围
● 小鼠抗dsDNA 抗体检测范围在15.6-1000 mU/mL内。
● 特异性
● 本ELISA系统使用的标识抗体对抗小鼠IgG抗体具有特异性。
● 与小鼠IgM的反应交差性在检测灵敏度以下。
● 精密度实验
● ①批次变动(N=30)平均C.V.值是4.2%
● ②日差可重复性实验(N=30、3天)平均C.V.值是4.7%
欲了解更多相关产品信息,请点击文字:LBIS® 疾病相关动物模型ELISA试剂盒系列
相关资料

◆注意事项
● 本试剂盒需要由掌握ELISA 法技术的人员,或者是在技术人员指导下使用。
● 手动操作测定时请使用对可重复性较稳定的移液器。
● 准备工作以及本试剂盒操作中,请穿戴手套,眼镜,保护服。
● 试剂类请不要接触皮肤。误将本试剂盒的试剂接触眼睛、口腔、伤口、皮肤等情况请立即进行应急处理,如用 ● 自来水彻底冲洗,必要时请就医。
● 使用本试剂盒的空间请不要进食和吸烟。
● 本试剂盒含有动物源成分。与测定样本一样可能会有感染的危险性,操作需要注意。
● 请不要使用加热灭活样本。
● 抗凝剂请使用除肝素以外试剂。
● 试剂类请勿入口。
● 批次号不同的产品请不要混合使用。
● 各步骤静置反应时,为防止板孔干燥、异物混入、分装试剂蒸发。请必须盖上盖板。
● ELISA法会受到测定环境影响的。测定操作、静置反应的室温严格控制在:20~25℃(实验台上或者是恒温箱 ● 内温度)。另外,避免在风速(也包括空调风)0.4 m/sec*以上,湿度不足30%的环境下测定。
*若想获取相关标准的内容请联系我们。
◆技术提示
● 请注意样本和试剂中不要混入不纯物。建议使用1孔/1枪头。
● 显色剂在96孔板使用前是无色或者透明的。请避光保存。
● 终止液在96孔板使用前是无色的。将终止液加入到孔中,颜色立即从蓝色变成黄色。
● 不得已在风速:0.4 m/sec以上,湿度不满30%的操作环境下测定时,各步骤的静置反应均需要盖上盖板,请 ● 采取增加各孔的密闭度措施。
例:用封口膜覆盖板孔,在其上面覆盖盖板,或者在恒温箱内,泡沫塑料箱内静置反应等。要根据测定环境的条件制定出不同的对策方法。具体详细ELISA技术信息请联系我们。
● 使用完的样本,使用的消耗品等请用1%福尔马林、2%戊二醛或者0.1%以上的次氯酸钠溶液浸泡1小时。或者 ● 高压灭菌处理后废弃。另外,使用的消耗品和未使用的药品请按照规定以及法律和它所属的设施各区域的规章丢● 弃。
◆试剂配制
● 试剂盒的试剂使用前必须恢复到室温(20-25℃)
● 请按照测定所需用量制备试剂。
● 请不要使用超过有效期(外箱记载)的试剂。
室温直接使用的试剂
[抗原包被96孔板]
稳定性和保存方法
未使用(在冷藏状态下请不要撕开密封膜)抗原包被袋是同捆的拉链密封袋,请在2-8℃保存。有效期内可稳定保存。
[缓冲液]和[显色液]
稳定性和保存方法
使用部分溶液时将适量液体移至其他容器,其余请不要恢复室温,直接拧紧盖子,置于2-8℃保存。有效期内保持稳定。
[终止液(1M H2SO4)]※注意操作
稳定性和保存方法
将剩余终止液瓶盖拧紧,置于2-8℃保存。有效期内保持稳定。
浓缩试剂类
[浓缩清洗液(10×)]
浓缩清洗液(10×)用室温的蒸馏水10倍稀释,制备成实用稀释倍数1×溶液。
例:100 mL的浓缩清洗液(10×)+900 mL蒸馏水(96孔板全部使用情况下)
稳定性和保存方法
浓缩清洗液(10×)保存时要拧紧瓶盖,置于2-8℃保存。有效期内保持稳定。使用残留的稀释液请废弃。
[标准抗小鼠dsDNA 抗体溶液(10000 mU/mL)];抗体标准曲线制作用
使用标准抗小鼠dsDNA 抗体溶液(10000 mU/mL)(原液)按下表(例)制成标准溶液。
|
标准溶液容量 |
缓冲液 |
浓度(mU/mL) |
|
原液50 μL |
450 μL |
1000 |
|
1000 mU/mL溶液250 μL |
250 μL |
500 |
|
500 mU/mL溶液250 μL |
250 μL |
250 |
|
250 mU/mL溶液250 μL |
250 μL |
125 |
|
125 mU/mL溶液250 μL |
250 μL |
62.5 |
|
62.5 mU/mL溶液250 μL |
250 μL |
31.3 |
|
31.3 mU/mL溶液250 μL |
250 μL |
15.6 |
|
0(空白) |
250 μL |
0 |
稳定性和保存方法
拆分试剂盒使用前从冷藏柜取出稀释制备,剩余原液不要置于室温,将瓶盖拧紧后,置于2-8℃保存。有效期内保持稳定。稀释的标准溶液直接使用,请不要保存。
[标记抗体(过氧化物酶结合抗小鼠IgG抗体)]
提供充分使用量20 μL。
请将浓缩液用缓冲液稀释2000倍(推荐分2步稀释)
稳定性和保存方法
拆分试剂盒使用前从冷藏柜取出稀释制备,剩余原液不要置于室温,将瓶盖拧紧后,置于2-8℃保存。有效期内保持稳定。剩余稀释液请废弃。
◆样本的制备
本试剂盒可测定小鼠血清或者血浆中抗小鼠dsDNA 抗体浓度。样本请按照常规方法采集的血清或者血浆。除肝素以外的抗凝剂均可使用。请不要使用加热灭活样本。根据测定范围(15.6-1000 mU/mL),利用试剂盒的缓冲液稀释样本。稀释倍数为51倍,101倍,201倍。稀释样本时,预先在试管等容器用缓冲液稀释,然后分装至检测孔中。若怀疑是有干扰物质影响的标本,在同一样本情况下,请稀释100倍以上方可测定。另外,请用不同2个点以上的稀释率确定稀释直线性。浑浊以及含有难溶物的样本需要离心分离除去后方可测定。另外,请不要使用溶血样本和高脂质样本。
稳定性和保存方法
样本采集后立即测定,需要一周内测定时,请保存在2-8℃条件下。另外,长时间保存情况下需要-35℃以下冻存管保存。测定前解冻样本需要充分搅拌,避免反复冻融。此为造成得不到正确结果的原因。
◆测定操作方法
[抗原包被微孔板的密封是,微孔板充分恢复到室温后方可除去。]
1.用预先制备清洗液对每孔加满清洗3遍。然后将板倒扣在纸巾上,轻轻叩击孔板除去残留液体。
2.准(抗体)溶液或者稀释样本溶液,每孔分装100 μL。
3.于微孔板振荡器充分搅拌**。
4.覆盖板盖,室温下静置2小时。
5.反应终止后,除去反应液,用清洗液对每孔加满清洗3遍。然后将板倒扣在纸巾上,轻轻叩击除去残留液体。
6.各板孔中分装标识抗体(过氧化物酶结合抗小鼠IgG抗体)100 μL,置于微孔板振荡器充分搅拌**。
7.覆盖板盖,室温下(20~25℃)静置2小时。
8.反应终止后,除去反应液,用清洗液对每孔清洗3遍*。然后将板倒扣在纸巾上,轻轻叩击除去残留液体。
9.向各孔分装显色液100 μL。置于微孔板振荡器充分搅拌**。
10.覆盖板盖,室温下(20~25℃)静置20分钟。
11.向各板分装终止液100 μL。终止显色反应。
12.将搅拌**后微孔板在分光光度计450 nm处(副波长620 nm)测定吸光度。
13.副波长是600-650 nm范围内使用。
注意
*清洗液的液量值是300 μL/孔。
使用平板清洗器的压力值:5-25 mL/分(取决于喷嘴的直径)
请注意清洗液倒出后的干燥情况。
**搅拌标准:800 rpm-10秒*3次
图1 工作表(例)
|
1&2列 |
3&4列 |
5&6列 |
7&8列 |
9&10列 |
11&12列 |
|
|
A |
100 mU/mL |
阳性对照 |
样本8 |
样本16 |
样本24 |
样本32 |
|
B |
500 mU/mL |
样本1 |
样本9 |
样本17 |
样本25 |
样本33 |
|
C |
250 mU/mL |
样本2 |
样本10 |
样本18 |
样本26 |
样本34 |
|
D |
125 mU/mL |
样本3 |
样本11 |
样本19 |
样本27 |
样本35 |
|
E |
62.5 mU/mL |
样本4 |
样本12 |
样本20 |
样本28 |
样本36 |
|
F |
31.3 mU/mL |
样本5 |
样本13 |
样本21 |
样本29 |
样本37 |
|
G |
15.6 |
样本6 |
样本14 |
样本22 |
样本30 |
样本38 |
|
H |
0 |
样本7 |
样本15 |
样本23 |
样本31 |
样本39 |
◆计算
1.制作抗体标准曲线。使用半对数X轴(Log)表示抗体浓度(mU/mL),Y轴表示吸光度的抗体标准曲线。
2.通过抗体标准曲线,获得稀释样本的吸光度对应的抗体浓度(mU/mL),抗体浓度乘以稀释倍数即为测定值。
*样本的吸光度在标准曲线吸光度以外的情况,用缓冲液进行适当地稀释后再次检测。
*吸光度在标准溶液最高浓度附近的样本需要用缓冲液进行适当地稀释后再次检测。
*计算机软件演算处理推荐使用3阶多项式,或4个参数。
*本试剂盒的测定值为小鼠样本的抗dsDNA 抗体浓度较方便确定的数值,这是使用本公司同一款试剂盒,以及使用其他设备的检测的数据进行比较的数值。小鼠的临床表现是由临床症状和其他的检测结果等进行综合判断。
抗体浓度标准曲线例子。(吸光度会根据测定环境而变化)
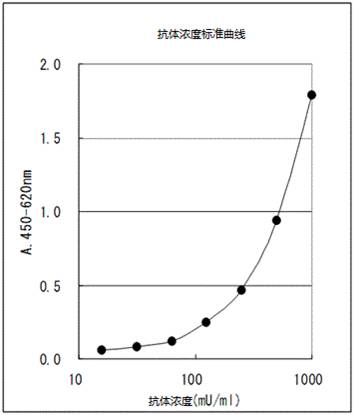
*所用酶标仪为SUNRISE RAINBOW(TECAN)
◆测定操作概述
*必须详细阅读操作说明书后再进行检测操作。
● 孔板、试剂类完全恢复到室温。
● 浓缩清洗液的稀释:用室温的蒸馏水稀释10倍。
● 标准溶液的稀释(例):用室温的缓冲液稀释。

● 阳性对照样本的制作,样本的制作。注:*最高浓度的标准溶液
|
抗原包被96孔板 |
|
|
↓洗净3次* |
|
|
稀释样本或标准(抗体)溶液 |
100 μL |
|
↓搅拌**,室温反应2小时(静置***) ↓清洗3次* 标记抗体(过氧化物结合抗小鼠IgG抗体) 的稀释用室温缓冲液,稀释2000倍 ↓清洗3次* |
|
|
标记抗体(过氧化物酶结合抗小鼠IgG抗体) |
100 μL |
|
↓搅拌**,室温反应2小时(静置***) ↓洗净3次* |
|
|
显色液(TMB) |
100 μL |
|
↓搅拌**,室温反应2小时(静置***) |
|
|
终止液(1M H2SO4)※注意操作 |
100 μL |
|
↓搅拌** |
|
|
吸光度测定(主波长450 nm,副波长620 nm) |
|
|
室温:20~25℃ |
|
*平板清洗机或者用移液枪添加清洗液时的液量值:300 μL/孔
*平板清洗机压力值:5-25 mL/分(取决于喷嘴的直径)
*请注意清洗液倒出后的干燥情况。
**搅拌标准:800 rpm-10秒*3次
**副波长请设定范围为600-650 nm。
***搅拌完毕后在96孔板上覆盖盖板后静置处理。
Q&A
● 全部孔的反应很弱
可能原因
⑴ 未加入标准品和样本。
⑵ 未加入显色相关试剂溶液
⑶ 弄错显色相关试剂溶液或未稀释制备。
⑷ 混入酶抑制剂。
⑸ 试剂盒保存温度的影响(冻存情况)
⑹ 微孔板清洗过度。
⑺ 显色液温度过低。
● 空白OD值比最小标准溶液浓度(15.6 mU/mL)的OD值高。
可能原因
清洗不当,清洗不完全。
(过氧化物酶结合抗体反应后清洗次数按照同样流速增加到4-6次。)
● 变动系数(CV)大
可能原因
① 清洗不当,清洗不完全。
② 准品和管理血清或者样本搅拌不充分。(请充分搅拌冻存样本)
③ 移液器操作不一致。
Q1:试剂盒拆分之后能使用吗?
A1:可以。请使用切割工具将贴在平板的透明密封条带切割分开。不用的平板需要密封后保存在冷藏柜中。
Q2:要是取出平板时孔中有液体,究竟是什么?
A2:出货时填充的保存稳定液。
|
[1] |
Original reports |
||||||||||||||||
|
Parasites alter the pathological phenotype of lupus nephritis |
|||||||||||||||||
|
Miyake. K.., Adachi. K.., Watanabe. M., Sasatomi. Y., Ogahara. S., Abe. Y., Ito. K., Dan Justin. YK., Saito. T., Nakashima. H. and Hamano. S. |
|||||||||||||||||
|
Autoimmunity, 24:1-10, Jun. 2014. |
|||||||||||||||||
|
[2] |
Reactivity of autoantibodies against not only erythrocytes but also hepatocytes in sera of mice with malaria |
||||||||||||||||
|
Kanda. Y., Kawamura. T., Kobayashi. T., Kawamura. H., Watanabe. H., Abo. T. |
|||||||||||||||||
|
Cellular Immunology, Vol.289(1-2), p162-166, May-Jun 2014. |
|||||||||||||||||
|
[3] |
Epicutaneous Application of Toll-like Receptor 7 Agonists Leads to Systemic Autoimmunity in Wild-Type Mice: A New Model of Systemic Lupus Erythematosus |
||||||||||||||||
|
Yokogawa. M.,Takaishi. M., Nakajima. K., Kamijima. R., Fujimoto. C., Kataoka. S., Terada. Y. and Sano. S. |
|||||||||||||||||
|
Arthritis & Rheumatology, Vol.66(3), p694-706, Mar. 2014. |
|||||||||||||||||
|
[4] |
Deficient Leptin Signaling Ameliorates Systemic Lupus Erythematosus Lesions in MRL/Mp-Faslpr Mice |
||||||||||||||||
|
Fujita. Y., Fujii. T., Mimori. T., Sato. T., Nakamura. T., Iwao. H., Nakajima A., Miki. M., Sakai. T., Kawanami. T., Tanaka. M., Masaki. Y., Fukushima. T., Okazaki. T. and Umehara. H. |
|||||||||||||||||
|
The Journal of Immunology, Vol.192(3), p979-984, Feb. 2014. |
|||||||||||||||||
|
[5] |
Autoimmune disorder phenotypes in Hvcn1-deficient mice |
||||||||||||||||
|
Sasaki. M., Tojo. A., Okochi. Y., Miyawaki. N., Kamimura. D., Yamaguchi. A., Murakami. M., and Okamura. Y. |
|||||||||||||||||
|
Biochem. J. Vol.450(2), p295-301, Mar. 2013. |
|||||||||||||||||
|
[6] |
Overexpression of Epstein-Barr virus-induced gene 3 protein (EBI3) in MRL/lpr mice suppresses their lupus nephritis by activating regulatory T cells |
||||||||||||||||
|
Nishimura Shinsuke and Inoue Hiroshi. |
|||||||||||||||||
|
Autoimmunity, 2013. |
|||||||||||||||||
|
[7] |
Suppression of glomerulonephritis in lupus prone NZB/W mice by RN486, a selective inhibitor of Bruton's Tyrosine Kinase |
||||||||||||||||
|
P.Mina-Osorio, J.LaStant, N.Keirstead, T.Whittard, J.Ayala, S.Stefanova, R. Garrido, N. Dimaano, H. Hilton, M. Giron, K.-Y.Lau, J.Hang, J.Postelnek,Y.Kim, S.Min, A. Patel, J.Woods, M.Ramanujam, J.DeMartino, S.Narula, D.Xu. |
|||||||||||||||||
|
Arthritis & Rheumatism, 2013. |
|||||||||||||||||
|
[8] |
Galectin-9 Ameliorates Clinical Severity of MRL/lpr Lupus-Prone Mice by Inducing Plasma Cell Apoptosis Independently of Tim-3 |
||||||||||||||||
|
M.Moritoki, T.Kadowaki, T.Niki, D.Nakano, G.Soma, H.Mori, H.Kobara, T.Masaki, M.Kohno, M.Hirashima. |
|||||||||||||||||
|
PLOS one, 2013. |
|||||||||||||||||
|
[9] |
Runx1 Deficiency in CD4+ T Cells Causes Fatal Autoimmune Inflammatory Lung Disease Due to Spontaneous Hyperactivation of Cells |
||||||||||||||||
|
W.F.Wong, K.Kohu, A.Nakamura, M.Ebina, T.Kikuchi, R.Tazawa, K.Tanaka, S.Kon, T.Funaki, A.Sugahara-Tobinai, C.Y.Looi, S.Endo, R.Funayama,M.Kurokawa, S.Habu, N.Ishii, M.Fukumoto, K.Nakata, T.Takai and M.Satake |
|||||||||||||||||
|
The Journal of Immunology, Vol.188(11), p5408-5420, Jun 2012. |
|||||||||||||||||
|
[10] |
Dendritic Cell-Specific Ablation of the Protein Tyrosine Phosphatase Shp1 Promotes Th1 Cell Differentiation and Induces Autoimmunity |
||||||||||||||||
|
T.Kaneko, Y.Saito, T.Kotani, H.Okazawa, H.Iwamura, M.Sato-Hashimoto, Y.Kanazawa, S.Takahashi, K.Hiromura, S.Kusakari, Y.Kaneko, Y.Murata,H.Ohnishi, Y. Nojima, K.Takagishi and T. Matozaki |
|||||||||||||||||
|
The Journal of Immunology, Vol.188(11), p5397-5407, Jun 2012. |
|||||||||||||||||
|
[11] |
Autoimmune disorder phenotypes in Hvcn1-deficient mice |
||||||||||||||||
|
Sasaki M, Tojo A, Okochi Y, Miyawaki N, Kamimura D, Yamaguchi A, Murakami M and Okamura Y. |
|||||||||||||||||
|
Biochem. J. Vol.450, p295-301, 2013. |
|||||||||||||||||
|
[12] |
Eradication of Metastatic Renal Cell Carcinoma after Adenovirus-Encoded TNF-Related Apoptosis-Inducing Ligand (TRAIL)/CpG Immunotherapy |
||||||||||||||||
|
L. A. Norian., T. P. Kresowik., H. M. Rosevear., B. R. James., T. R. Rosean., A. J. Lightfoot., T. A. Kucaba., C. Schwarz., C. J. Weydert., M. D. Henry., T. S. Griffith. |
|||||||||||||||||
|
PLos One 7(2):e31085. 2012 |
|||||||||||||||||
|
[13] |
Reversal of serologic, immunologic, and histologic dysfunction in mice with systemic lupus erythematosus by long-term serial adipose tissue-derived mesenchymal stem cell transplantation |
||||||||||||||||
|
E.W. Choi., Il S. Shin., S. Y. Park., J. H. Park., J. S. Kim., E. J. Yoon., S. K. Kang., J. C. Ra., S. H. Hong. |
|||||||||||||||||
|
Arthritis & Rheumatism Vol. 64, Issue 1, pages 243-253, 2012 |
|||||||||||||||||
|
[14] |
Serum soluble MD-1 levels increase with disease progression in autoimmune prone MRLlpr/lpr mice |
||||||||||||||||
|
S. Sasakia., Y. Nagaia., T. Yanagibashia., Y. Watanabea., M. Ikutania., A. Kariyonea., K. Tsuneyamab., Y. Hiraia., K. Takatsua. |
|||||||||||||||||
|
Molecular Immunology Vol.49,Issue4,611-620, 2012 |
|||||||||||||||||
|
[16] |
Deamidation of Gliadin Peptides in Lamina Propria: Implications for Celiac Disease |
||||||||||||||||
|
H. Skovbjerg., D. Anthonsen., E. Knudsen. and H. Sjostrom. |
|||||||||||||||||
|
J of Clinical Immunology Vol.31 ( 6) 1038-1044 , 2011 |
|||||||||||||||||
|
[17] |
Transgenic Mice that Overexpress Human IL-15 in Enterocytes Recapitulate Both B and T Cell-Mediated Pathologic Manifestations of Celiac Disease |
||||||||||||||||
|
S. Yokoyama., K. Takada., M. Hirasawa., L. P. Perera., and T. Hiroi. |
|||||||||||||||||
|
J of Clinical Immunology Vol. 31,(6) , 2011 |
|||||||||||||||||
|
[18] |
Coincidence of autoantibody production with the activation of natural killer T cells in a-galactosylceramide-mediated hepatic injury |
||||||||||||||||
|
H. Matsumoto., T. Kawamura., T. Kobayashi., Y. Kanda., H. Kawamura., T. Abo. |
|||||||||||||||||
|
Immunology Vol. 133, Issue 1, pages 21-28, 2011 |
|||||||||||||||||
|
[19] |
Lack of B and T lymphocyte attenuator exacerbates autoimmune disorders and induces Fas-independent liver injury in MRL-lpr/lpr mice |
||||||||||||||||
|
Y. Oya., N. Watanabe. Y. Kobayashi., T. Owada., M. Oki., K. Ikeda. A. Suto., S. Kagami., K. Hirose., T. Kishimoto., and H. Nakajima. |
|||||||||||||||||
|
Int. Immunol 23 (5): 335-344, 2011 |
|||||||||||||||||
|
[20] |
Amelioration of systemic lupus erythematosus by withangulatin A in MRL/lpr mice |
||||||||||||||||
|
L. Sun., L. Zhou., M. Chen., R. Zhong., J. Liu. |
|||||||||||||||||
|
Journal of Cellular Biochemistry Vol. 112, Issue 9, pages 2376-2382, 2011 |
|||||||||||||||||
|
[21] |
Co-appearance of autoantibody-producing B220low B cells with NKT cells in the course of hepatic injury |
||||||||||||||||
|
Y. Fujii., H. Kawamura., T. Kawamura., Y. Kanda.,H. Matsumoto., T. Kobayashi., T. Yamamoto., T. Aoyama., T. Abo. |
|||||||||||||||||
|
Cellular Immunology Vol.260,Issue2, 105-112, 2010 |
|||||||||||||||||
|
[22] |
Identification and characterization of autoantibody-producing B220low B (B-1) cells appearing in malarial infection |
||||||||||||||||
|
Y. Kanda., H. Kawamura., H. Matsumoto., T. Kobayashi., T. Kawamura., T. Abo. |
|||||||||||||||||
|
Cellular Immunology Vol.263,Issue1, 49-54, 2010 |
|||||||||||||||||
|
[23] |
Transplantation of umbilical cord mesenchymal stem cells alleviates lupus nephritis in MRL/lpr mice |
||||||||||||||||
|
Z. Gu., K. Akiyama., X. Ma., H. Zhang., X. Feng., G. Yao., Y. Hou., L. Lu., GS. Gilkeson., RM. Silver., X. Zeng., S. Shi., L. Sun |
|||||||||||||||||
|
Lupus Vol.19 No.13, 1502-1514, 2010 |
|||||||||||||||||
|
[24] |
Augmented TLR9-induced Btk activation in PIR-B-deficient B-1 cells provokes excessive autoantibody production and autoimmunity |
||||||||||||||||
|
T. Kubo., Y. Uchida., Y. Watanabe., M. Abe., A. Nakamura., M. Ono., S. Akira., and T. Takai. |
|||||||||||||||||
|
J of Experimental Medicine Vol.206 No.9 1971-1982, 2009 |
|||||||||||||||||
|
[25] |
Deficiency in EBV-induced gene 3 (EBI3) in MRL/ lpr mice results in pathological alteration of autoimmune glomerulonephritis and sialadenitis |
||||||||||||||||
|
T. Igawa., H. Nakashima., A. Sadanaga., K. Masutani., K. Miyake., S. Shimizu., A. Takeda., S. Hamano., and H. Yoshida. |
|||||||||||||||||
|
Modern Rheumatology Vol. 19, Number 1, 33-41, 2009 |
|||||||||||||||||
|
[26] |
Oncostatin M deficiency leads to thymic hypoplasia, accumulation of apoptotic thymocytes and glomerulonephritis |
||||||||||||||||
|
E. Esashi1., H. Ito., K. Minehata., S. Saito., Y. Morikawa., A. Miyajima. |
|||||||||||||||||
|
European Journal of Immunology Vol.39,Issue6, 1664-1670, 2009 |
|||||||||||||||||
|
[27] |
Amelioration of human lupus-like phenotypes in MRL/lpr mice by overexpression of interleukin 27 receptor a (WSX-1) |
||||||||||||||||
|
N. Sugiyama., H. Nakashima., T. Yoshimura., A. Sadanaga., S. Shimizu., K. Masutani., T. Igawa., M. Akahoshi., K. Miyake., A. Takeda., A. Yoshimura., S. Hamano., H. Yoshida. |
|||||||||||||||||
|
Ann Rheum Dis 67:1461-1467, 2008 |
|||||||||||||||||
|
[28] |
Development of autoantibody responses in NC/Nga mice: its prevention by pulverized konjac glucomannan feeding |
||||||||||||||||
|
N. Onishi., S. Kawamoto., H. Suzuki., M. Hide., and K. Ono. |
|||||||||||||||||
|
Archives of Dermatological Research Vol.300, 95-99, 2008 |
|||||||||||||||||
|
[29] |
CD19 Regulates Skin and Lung Fibrosis via Toll-Like Receptor Signaling in a Model of Bleomycin-Induced Scleroderma |
||||||||||||||||
|
A. Yoshizaki., Y. Iwata., K. Komura., F. Ogawa., T. Hara., E. Muroi., M. Takenaka., K. Shimizu., M. Hasegawa., M. Fujimoto., T. F. Tedder., and S. Sato. |
|||||||||||||||||
|
Am J Pathol. 172(6): 1650-1663, 2008 |
|||||||||||||||||
|
[30] |
Protection against autoimmune nephritis in MyD88-deficient MRL/lpr mice |
||||||||||||||||
|
A. Sadanaga., H. Nakashima., M. Akahoshi., K. Masutani., K. Miyake., T. Igawa., N. Sugiyama., H. Niiro., M. Harada. |
|||||||||||||||||
|
Arthritis & Rheumatism Vol.56, Issue 5, pages 1618-1628, 2007 |
|||||||||||||||||
|
[31] |
Chronic polyarthritis caused by mammalian DNA that escapes from degradation in macrophages. |
||||||||||||||||
|
Kawane, K., Ohtani, M., Miwa, K., Kizawa, T., Kanbara, Y., Yoshioka, Y., and Yoshikawa, H. |
|||||||||||||||||
|
Nature 443: 998-1002, 2006 |
|||||||||||||||||
|
[32] |
Altered cytokine expression in mesenteric lymph nodes in a rat strain (Matsumoto Eosinophilic Shinshu) that spontaneously develops hypereosinophilia |
||||||||||||||||
|
S. Muto., M. Monnai., Y. Okuhara., M. Murakami., J. Kuroda., T. Ono., K. Matsumoto. |
|||||||||||||||||
|
Immunology Vol. 116, Issue 3, pages 373-380, 2005 |
|||||||||||||||||
|
[33] |
Amelioration of autoimmune nephritis by imatinib in MRL/lpr mice |
||||||||||||||||
|
Sadanaga, A., Nakashima, H., Masutani, K., Miyake, K., shimizu, S., Igawa, T., Sugiyama, N., Niiro, H., Hirakata, H., and Harada, M. |
|||||||||||||||||
|
Arthritis Rheumatism 52: 3987-3996, 2005 |
|||||||||||||||||
|
[34] |
Membranous glomerulonephritis development with Th2-type immune deviations in MRL/lpr mice deficient for IL-27 receptor (WSX-1) |
||||||||||||||||
|
Shimizu, S., Sugiyama, N., Matsutani, K., Sadanaga, A., Miyazaki, Y., Inoue, Y., Akaboshi, M., Katafuchi, R., Hirakata, H., Harada. M., Hamano, S., Nakashima, H., and Yoshida, H. |
|||||||||||||||||
|
J Immunol 175:7185-7192, 2005 |
|||||||||||||||||
|
[35] |
Glucose intolerance in young TallyHo mice is induced by leptin-mediated inhibition of insulin. |
||||||||||||||||
|
Sung, Y.Y., Lee, Y.S., Jung, W.H., Kim, H.Y., Cheon, H.G., Yang, S.D., and Rhee, S.D. |
|||||||||||||||||
|
Biochem Biopys Res Commun. 338: 1779-1787, 2005 |
|||||||||||||||||
|
[36] |
Requirement for CD100-CD72 interactions in fine-tubing of B-cell antigen receptor signaling and homeostatic maintenance ofthe B-cell compartment. |
||||||||||||||||
|
Kumanogoh, A., Shikina, T., Watanabe, C., Takegahara, N., Suzuki, K., Yamamoto, M., Takamatsu, H., Prasad, D.V.R., Mizui, M., Toyohuku, T., Tamaru, M., Watanabe, D., Parnes, J.R., and Kikutani, H. |
|||||||||||||||||
|
International Immuno, 17: 1277-1282, 2005 |
|||||||||||||||||
|
[37] |
Chemical induction of HO-1 suppresses lupus nephritis by reducing local iNOS expression and synthesis of anti-dsDNA antibody. |
||||||||||||||||
|
Takeda, Y., Takeno, M., Iwasaki, M., Kobayashi, H., Kirino, Y., Ueda, A., Nagahama, K., Aoki, I., and Ishigatsubo, Y |
|||||||||||||||||
|
Clin Exp Immunol. 138:237-244, 2004 |
|||||||||||||||||
|
[38] |
The point mutation of tyrosine 759 of the IL-6 family cytokine receptor gp130 synergizes with HTLV-1 pX in promoting rheumatoid arthritis-like arthritis. |
||||||||||||||||
|
Ishihara, K., Sawa, S., Ikushima, H., Hirota, S., Atsumi, T., Kamimura, D., Park, S.J., Murakami, M., Kitanuma, Y., Iwakura, Y., and Hirano, T. |
|||||||||||||||||
|
International Immunol. 16: 455-465, 2004 |
|||||||||||||||||
|
[39] |
Inadequate induction of suppressor of cytokine signaling-1 causes systemic autoimmune disease |
||||||||||||||||
|
Fujimoto, M., Tsutsui, H., Xinshou, O., Tokumoto, M., Watanabe, D., Shima, Y., Yoshimoto, T., Hirakata, H., Kawase, I., Nakanishi, K., Kishimoto, T., and Naka, T. |
|||||||||||||||||
|
International Immunol. 16: 303-314, 2004 |
|||||||||||||||||
|
[40] |
Suppressor of cytokine signaling-1 is essential for suppressing dendritic cell activation and systemic autoimmunity. |
||||||||||||||||
|
Hanada, T., Yoshida, H., Kato, S., Tanaka, K., Matsutani, K., Tsukada, J., Nomura, Y., Mimata, H., Kubo, M., and Yoshimura, A. |
|||||||||||||||||
|
[41] |
Association of Cathepsin E Deficiency with Development of Atopic Dermatitis |
||||||||||||||||
|
Tsukuba et al. |
|||||||||||||||||
|
J Biochem (Tokyo). 134: 893-902, 2003 |
|||||||||||||||||
|
[42] |
Fc RIIB deficiency with Fas mutation is sufficient for the development of systemic autoimmune disease. |
||||||||||||||||
|
Yajima, K., Nakamura, A., Sugahara, A., and Takai, T. |
|||||||||||||||||
|
Eur J Immunol, 33:(4) 1020-1029, 2003 |
|||||||||||||||||
|
[43] |
A Point Mutation of Tyr-759 in Interleukin 6 Family Cytokine Receptor Subunit gp130 Causes Autoimmune Arthritis |
||||||||||||||||
|
T. Atsumi., K. Ishihara., D. Kamimura., H. Ikushima., T. Ohtani., S. Hirota., H. Kobayashi., S. Park., Y. Saeki., Y. Kitamura. and T. Hirano |
|||||||||||||||||
|
J Exp Med, 196, Number 7, 979-990, 2002 |
|||||||||||||||||
|
[44] |
A novel assay kits for autoantibodies rate on spontaneous autoimmune model mice. |
||||||||||||||||
|
Kikukawa, T, Kojima, M., and Abe, C. |
|||||||||||||||||
|
Jap J Inflammation 20: 697-701, 2000 |
|||||||||||||||||
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 631-02699 | LBIS® Mouse Anti-dsDNA ELISA Kit LBIS® 抗dsDNA-小鼠ELISA试剂盒 |
96 tests | - | - |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
细胞凋亡 M30 Apoptosense® ELISA试剂盒 M30 Apoptosense® ELISA
细胞凋亡 M30 Apoptosense® ELISA试剂盒
M30 Apoptosense® ELISA
- 产品特性
- 相关资料
- Q&A
- 参考文献
细胞凋亡M30 Apoptosense® ELISA试剂盒![]()
M30 Apoptosense® ELISA
◆原理
M30 Apoptosense® ELISA 是 PEVIVA 的畅销产品。可用于定量检测表达角蛋白18(K18)细胞(人)的凋亡情况。检测结果可信度高,检测结果重复性好。特异性检测可信度高是因为 M30 Apoptosense® ELISA 只单独检测可溶性 caspase-cleaved 角蛋白18(细胞凋亡产物)。
该产品广泛运用于肝脏疾病,肿瘤,毒理学等研究领域。
M30 Apoptosense® ELISA 可用于检测人血清,并且带有 CE 标记(可用于体外诊断)。所有试剂都是即用型的。

◆优点・特色
● 特异性定量检测表达角蛋白18细胞的细胞凋亡,包括肝细胞,乳腺癌、肺癌、前列腺癌、结肠癌等上皮细胞来源的肿瘤细胞。
● 可用于早期凋亡研究,比常规的 Annexin V 检测灵敏度高。可检测血清、血浆和细胞培养上清的样品。常规检测细胞凋亡,需要制备细胞裂
解液,取材不方便。
● 可检测多种 caspase 介导的细胞凋亡(比如 caspase-3,-7,-9)
● 夹心 ELISA 法进行检测,96 孔板,板子可拆卸。试剂即拆即用。
● 与M65® ELISA 配套使用,定量检测细胞凋亡、细胞坏死和总细胞死亡。
● 肝脏疾病:定量检测患肝脏疾病病人的肝细胞凋亡情况,可预测患肝脏疾病的可能性。
● 肿瘤:监测上皮细胞肿瘤患者化疗诱导肿瘤细胞凋亡的情况。
● 毒理学:临床评估不同药物对肝脏细胞的毒性。
M30 Apoptosense® 是基于M30单抗的ELISA试剂盒(Leers et al., 1999)。 该抗体可以特异性结合 caspase-cleaved 角蛋白18(ccK18、caspase-celaved cytokeratin 18、ccCK18 或者 K18-Asp396)。caspase 水解角蛋白18形成3个片段,其中1个片段氨基酸第 387 位-第 396 位含有新表位(neoeptitope),这个片段就称为 caspase-cleaved 角蛋白),但是不结合天然、未切除的 K18。 M30 Apoptosense® 因此可特异性检测上皮细胞的凋亡情况(Hägg et al. 2002)。
◆案例・应用
● 监测肿瘤治疗
人经常患的肿瘤包括肺癌,乳腺癌,前列腺癌和结肠癌。这些肿瘤细胞起源于上皮细胞,并且表达 K18。肿瘤治疗过程中肿瘤细胞发生凋亡,K18被水解后释放到细胞外和血液中。相比较而言,其他类型细胞比如淋巴细胞化疗后细胞发生凋亡不会产生 K18 片段。 Caspase-cleaved CK18 因此成为理想的血液型细胞凋亡标记物。进来研究发现接受不同治疗方案的肿瘤患者,其血清中的 caspase-cleaved K18(ccK18, K18Asp396-NE 或者 M30新表位)有所提高(Kramer et al., 2004; Kramer et al., 2006)。这个提升与临床治疗有关。(Olofsson et al., 2007, Scott et al., 2009, Hou et al., 2009)
● 肝脏疾病
肝细胞表达 K18。在涉及细胞凋亡的肝脏疾病比如肝纤维化、肝脏损伤中 K18 发生水解,导致组织中 M30 表位暴露(Bantel et al. 2001)。患有肝细胞凋亡相关的疾病包括丙肝病毒感染(Bantel et al., 2004),乙肝病毒感染(Papatheodoridis et al., 2008),非酒精的脂肪肝(NASH)(Wieckowska et al. 2006),毒剂相关脂肪肝(NASH)(Cave et al., 2010),胆道炎症和严重胆汁郁结(Yagmur et al., 2007)的患者,其血液循环中可溶性 caspase-cleaved K18-Asp396 片段升高。
● 其他运用
由细胞凋亡引起细胞死亡的其他疾病。检测 caspase-cleaved K18 片段证实可用于严重白血病患者的早期预测(Hofer et al., 2009)。
M30 Apoptosense® ELISA 可用于监测器官移植的病人(Luft et al., 2007),也可用于肝脏移植期间 caspase 抑制剂的临床实验(Baskin‑Bey et al., 2007)。
◆产品信息
M30-Apoptosense® ELISA kit (CE-Mark)
在体内外实验中定量检测上皮细胞的凋亡。使用血浆样品,可以特异性定量检测小鼠模型中人的异种移植物的凋亡情况。
|
特异性 |
人 |
|
样品类型 |
含有从凋亡上皮细胞中释放的 CK18 的血清或者血浆(EDTA、citrate、heparin plasma);含有 CK18 阳性的凋亡细胞或者组织的细胞裂解液或者上清 |
|
灵敏度 |
25 U/L,Standard A (0U/L)+ 2 S.D. |
|
范围 |
75-1,000 U/L |
|
检测目标物 |
可溶性 caspase 酶解的 CK18 |
| 特点 |
可进行定量检测;试剂盒中包含两个阳性对照;预铺 ELISA 板(可拆卸)、即用试剂,操作方便;可用于自动化 |
更多运用案例
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 10011 | M30 Apoptosense® ELISA 细胞凋亡M30 Apoptosense ® ELISA试剂盒 |
96 wells | – | – |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
LBIS® 抗dsDNA抗体检测用ELISA Kit LBIS® 自我免疫疾病 肾病研究
LBIS® 抗dsDNA抗体检测用ELISA Kit
LBIS® 自我免疫疾病 肾病研究
- 产品特性
- 相关资料
- Q&A
- 参考文献
自我免疫疾病 肾病研究
抗 dsDNA 抗体检测用 ELISA Kit
■ LBIS® Anti dsDNA-Mouse ELISA Kit
■ LBIS® Anti ssDNA-Mouse ELISA Kit
■ LBIS® Rheumatoid Factor IgG-Mouse ELISA Kit
■ LBIS® Rheumatoid Factor IgM-Mouse ELISA Kit
◆特点
● 短时间测定
● 微量样品(稀释样品)可测
● 使用对环境无害的防腐剂
● 全部试剂均为液体,可直接使用
● 精密的测定精度和高再现性
● 标准曲线范围:15.6~1,000 mU/mL
◆精度测试
● 组内变异:平均 C.V.值 10% 以下
● 组间变异:平均 C.V.值 10% 以下
◆样品:血清或血浆
● 含抗 dsDNA 和抗 ssDNA 的血浆采血是不可使用肝素
● 用本品配备的缓冲液稀释检体,稀释范围如下:
稀释倍数: 51 倍、101 倍、201~
MRL/lpr产生抗体随时间的变化
MRL/lpr 小鼠(n=7)
随着时间的推移,测量血清抗体 MRL/lpr 小鼠(n=7)的值。
测试值为平均值±标准偏差值,随着年龄增加,自身抗体增加。
治疗实验与 MRL/lpr 20 周龄相比较 IgG-RF 抗体,IgM-RF 抗体,抗 ssDNA 抗体值有意的受到抑制。(*p<0.05)
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 637-02691 | (AKRDD-061)LBIS® Anti dsDNA-Mouse ELISA Kit | 96 tests | – | – |
| 630-02701 | (AKRSD-051)LBIS® Anti ssDNA-Mouse ELISA Kit | 96tests | – | – |
| 633-02671 | (AKRRG-101)LBIS® Rheumatoid Factor IgG-Mouse ELISA Kit | 96tests | – | – |
| 630-02681 | (AKRRG-111)LBIS® Rheumatoid Factor IgM-Mouse ELISA Kit | 96tests | – | – |
| 639-02891 | (AKRIE-010)LBIS® IgE Mouse ELISA Kit | 96 tests | – | – |
| 632-04341 | (AKRIE-011)LBIS® IgE Rat ELISA Kit | 96 tests | – | – |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
LBIS® 小鼠胰岛素 ELISA 试剂盒(T 型) LBIS® Insulin-Mouse-T
LBIS® 小鼠胰岛素 ELISA 试剂盒(T 型)
LBIS® Insulin-Mouse-T
- 产品特性
- 相关资料
- Q&A
- 参考文献
LBIS® Insulin-Mouse-T
LBIS® 小鼠胰岛素 ELISA 试剂盒(T 型)
胰岛素是由胰脏内的胰岛β细胞分泌,分子量约 5800,等电点在 5.4 左右的一种蛋白质激素。
A6-A11、A7-B7、A20-B-19 之间形成二硫键,在酸性溶液或者不含 Zn 离子的中性水溶液中形成二聚体,在含锌离子的中性溶液中,则形成含2个 Zn 离子的六聚体。
肝脏、肌肉、脂肪组织是主要的靶组织,分别有以下的作用。
肝脏:促进糖原、蛋白质、脂肪酸合成、促进糖类的摄取和利用、抑制糖异生。
肌肉:糖类、氨基酸、K细胞膜通透性增大、促进糖原、蛋白质的合成、抑制蛋白质分解。
脂肪组织:葡萄糖细胞膜通透性增大、促进脂肪酸的合成。
胰岛素是细胞内的合成单链胰岛素原通过二硫键结合一起形成的。在酶分解作用下被激活,C肽和胰岛素分离。
◆特点
● 短时间测定(总的反应时间:3小时)
● 微量样品(标准操作:10 μL)可测
● 使用对环境无害的防腐剂
● 全部试剂均为液体,可直接使用
● 精密的测定精度和高再现性
● 操作简便,不需要特别的预处理
● 有效期限为 12 个月
◆构成
|
组成部分 |
状态 |
容量 |
|
(A) 抗体固相化 96孔板 |
洗净后使用 |
96 wells(8×12)/1 块 |
|
(B) 胰岛素标准溶液(小鼠)(200 ng/mL) |
稀释后使用 |
25 μL/1 瓶 |
|
(C) 缓冲液 |
即用 |
60 mL/1 瓶 |
|
(D) 生物素结合抗胰岛素抗体 |
稀释后使用 |
10 μL/1 瓶 |
|
(E) 过氧化物・抗生物素蛋白结合物 |
稀释后使用 |
20 μL/1 瓶 |
|
(F) 显色液(TMB) |
即用 |
12 mL/1 瓶 |
|
(H) 反应终止液(1M H2SO4)※小心轻放 |
即用 |
12 mL/1 瓶 |
|
( I ) 浓缩洗净液(10×) |
稀释后使用 |
100 mL/1 瓶 |
|
封板膜 |
3 张 |
|
|
使用说明书 |
1 份 |
◆样品信息
小鼠的血清、血浆、培养液
10 μL/well(标准操作)
※血浆采血建议使用肝素处理血液
◆测量范围
0.156~10 ng/mL(标准曲线范围)
◆Validation data
精度测试(组内变异)
|
样品 |
A |
B |
C |
D |
|
mean |
0.882 |
1.15 |
3.67 |
5.25 |
|
SD |
0.0245 |
0.0213 |
0.0649 |
0.0792 |
|
CV(%) |
2.78 |
1.87 |
1.77 |
1.51 |
单位:ng/mL n=10
重复性测试(组间变异)
|
测量日/样品 |
E |
F |
G |
|
第0天 |
5.253 |
1.224 |
0.513 |
|
第1天 |
5.322 |
1.312 |
0.523 |
|
第2天 |
5.365 |
1.269 |
0.512 |
|
第3天 |
5.362 |
1.281 |
0.535 |
|
mean |
5.326 |
1.272 |
0.521 |
|
SD |
0.0520 |
0.0366 |
0.0109 |
|
CV(%) |
3.31 |
3.76 |
4.65 |
单位:ng/mL n=3
加标回收测试
样品H
|
添加量 |
实测值 |
回收量 |
回收率(%) |
|
0 |
1.350 |
– |
– |
|
0.25 |
1.593 |
0.243 |
97.2 |
|
0.50 |
1.841 |
0.491 |
98.2 |
|
0.75 |
2.065 |
0.715 |
95.3 |
|
1.00 |
2.299 |
0.949 |
94.9 |
单位:ng/mL n=3
样品I
|
添加量 |
实测值 |
回收量 |
回收率(%) |
|
0 |
1.941 |
– |
– |
|
0.50 |
2.496 |
0.505 |
101 |
|
0.75 |
2.728 |
0.737 |
98.3 |
|
1.00 |
2.955 |
0.964 |
96.4 |
|
1.50 |
3.431 |
1.440 |
96.0 |
单位:ng/mL n=3
稀释直线性测试
用稀释缓冲液分3次连续稀释3个血清样品的测量结果,直线回归方程的 R2在 0.993~0.999 之间。
参考文献
|
1. |
Endoplasmic Reticulum Stress in Mice Increases Hepatic Expression of Genes Carrying a Premature Termination Codon via a Nutritional Status-Independent GRP78-Dependent Mechanism.Harada N, Okuyama M, Yoshikatsu A, Yamamoto H, Ishiwata S, Hamada C, Hirose T, Shono M, Kuroda M, Tsutsumi R, Takeo J, Taketani Y, Nakaya Y, Sakaue H.J Cell Biochem. 2017 Nov;118(11):3810-3824. |
|
2. |
Effects of β-Glucan Content and Pearling of Barley in Diet-Induced Obese MiceSeiichiro Aoe, Yasunori Ichinose, Noriko Kohyama, Kozo Komae, Asuka Takahashi, Toji Yoshioka, and Takashi Yanagisawa.Posted online on 27 Sep 2017. https://doi.org/10.1094/CCHEM-04-17-0083-R |
|
3. |
10-Hydroxy-2-decenoic acid, a natural product, improves hyperglycemia and insulin resistance in obese/diabetic KK-Ay mice, but does not prevent obesity Risa WATADANI, Jun KOTOH, Daiki SASAKI, Azusa SOMEYA, Kozo MATSUMOTO, Akihiko MAEDA Journal of Veterinary Medical Science, Vol. 79 (2017) No. 9 Sept, p.1596-1602 |
|
4. |
S-Equol Activates cAMP Signaling at the Plasma Membrane of INS-1 Pancreatic β-Cells and Protects against Streptozotocin-Induced Hyperglycemia by Increasing β-Cell Function in Male Mice. Horiuchi H, Usami A, Shirai R, Harada N, Ikushiro S, Sakaki T, Nakano Y, Inui H, Yamaji R. J Nutr. 2017 Sep;147(9):1631-1639. |
|
5. |
Pathological and gene expression analysis of a polygenic diabetes model, NONcNZO10/LtJ mice. Hirata T, Yoshitomi T, Inoue M, Iigo Y, Matsumoto K, Kubota K, Shinagawa A. Gene. 2017 Sep 20;629:52-58. |
|
6. |
Suppression of GRK2 expression reduces endothelial dysfunction by restoring glucose homeostasis. Taguchi K, Hida M, Hasegawa M, Narimatsu H, Matsumoto T, Kobayashi T. Sci Rep. 2017 Aug 16;7(1):8436. |
|
7. |
Gender difference in NASH susceptibility: Roles of hepatocyte Ikkβ and Sult1e1. Matsushita N, Hassanein MT, Martinez-Clemente M, Lazaro R, French SW, Xie W, Lai K, Karin M, Tsukamoto H. PLoS One. 2017 Aug 10;12(8):e0181052. |
|
8. |
Intake of mulberry 1-deoxynojirimycin prevents colorectal cancer in mice. E S, Yamamoto K, Sakamoto Y, Mizowaki Y, Iwagaki Y, Kimura T, Nakagawa K, Miyazawa T, Tsuduki T. J Clin Biochem Nutr. 2017 Jul;61(1):47-52. |
|
9. |
Sake lees extract improves hepatic lipid accumulation in high fat diet-fed mice. Kubo H, Hoshi M, Matsumoto T, Irie M, Oura S, Tsutsumi H, Hata Y, Yamamoto Y, Saito K Lipids Health Dis. 2017 Jun 3;16(1):106. |
|
10. |
Moringa oleifera from Cambodia Ameliorates Oxidative Stress, Hyperglycemia, and Kidney Dysfunction in Type 2 Diabetic Mice. Tang Y, Choi EJ, Han WC, Oh M, Kim J, Hwang JY, Park PJ, Moon SH, Kim YS, Kim EK. J Med Food. 2017 May;20(5):502-510. |
|
11. |
4μ8C Inhibits Insulin Secretion Independent of IRE1α RNase Activity. Sato H, Shiba Y, Tsuchiya Y, Saito M, Kohno K. Cell Struct Funct. 2017 May 3;42(1):61-70 |
|
12. |
Inhibition of Gastric Inhibitory Polypeptide Receptor Signaling in Adipose Tissue Reduces Insulin Resistance and Hepatic Steatosis in High-Fat Diet-Fed Mice. Joo E, Harada N, Yamane S, Fukushima T, Taura D, Iwasaki K, Sankoda A, Shibue K, Harada T, Suzuki K, Hamasaki A, Inagaki N. Diabetes. 2017 Apr;66(4):868-879. |
|
13. |
Prevention and treatment effect of evogliptin on hepatic steatosis in high-fat-fed animal models. Kim MK, Chae YN, Ahn GJ, Shin CY, Choi SH, Yang EK, Sohn YS, Son MH Arch Pharm Res. 2017 Feb;40(2):268-281. |
|
14. |
Royal jelly improves hyperglycemia in obese/diabetic KK-Ay mice. Mei YOSHIDA, Kaori HAYASHI, Risa WATADANI, Yoshiyasu OKANO, Keiya TANIMURA, Jun KOTOH, Daiki SASAKI, Kozo MATSUMOTO, Akihiko MAEDA Journal of Veterinary Medical Science, Vol. 79 (2017) No. 2 February p. 299-307 |
|
15. |
PDK1-FoxO1 pathway in AgRP neurons of arcuate nucleus promotes bone formation via GHRH-GH-IGF1 axis. Sasanuma H, Nakata M, Parmila K, Nakae J, Yada T. Mol Metab. 2017 Feb 17;6(5):428-439. |
|
16. |
Soy Protein Isolate Suppresses Lipodystrophy-induced Hepatic Lipid Accumulation in Model Mice. Nagao K, Matsumoto A, Kai S, Kayashima T, Yanagita T. J Oleo Sci. 2017 Feb 1;66(2):161-169. |
|
17. |
A high-fat diet temporarily renders Sod1-deficient mice resistant to an oxidative insult. Ito J, Ishii N, Akihara R, Lee J, Kurahashi T, Homma T, Kawasaki R, Fujii J J Nutr Biochem. 2017 Feb;40:44-52. |
|
18. |
Macrophage ubiquitin-specific protease 2 modifies insulin sensitivity in obese mice. Saito N, Kimura S, Miyamoto T, Fukushima S, Amagasa M, Shimamoto Y, Nishioka C, Okamoto S, Toda C, Washio K, Asano A, Miyoshi I, Takahashi E, Kitamura H. Biochem Biophys Rep. 2017 Jan 26;9:322-329. |
|
19. |
Dietary Mung Bean Protein Reduces Hepatic Steatosis, Fibrosis, and Inflammation in Male Mice with Diet-Induced, Nonalcoholic Fatty Liver Disease. Watanabe H, Inaba Y, Kimura K, Asahara SI, Kido Y, Matsumoto M, Motoyama T, Tachibana N, Kaneko S, Kohno M, Inoue H. J Nutr. 2017 Jan;147(1):52-60. |
|
20. |
BCL11B gene heterozygosity causes weight loss accompanied by increased energy consumption, but not defective adipogenesis, in mice Jun Inoue, Yusuke Ihara, Daisuke Tsukamoto, Keisuke Yasumoto, Tsutomu Hashidume, Kenya Kamimura, Shigeki Hirano, Makoto Shimizu, Ryo Kominami & Ryuichiro Sato Bioscience, Biotechnology, and Biochemistry, Vol.81, 2017,Issue 5, p922-930 |
|
21. |
Macrophage ubiquitin-specific protease 2 modifies insulin sensitivity in obese mice. Natsuko Saitoa,Shunsuke Kimurac,Tomomi Miyamotod,Sanae Fukushimae,Misato Amagasaa,Yoshinori Shimamotob, Chieko Nishiokae,Shiki Okamotof,Chitoku Todag,Kohei Washioa,Atsushi Asanoh,Ichiro Miyoshid,Eiki Takahashie,Hiroshi Kitamura Biochemistry and Biophysics Reports,Volume 9, March 2017, Pages 322-329 |
|
22. |
Agmatine ameliorates type 2 diabetes induced-Alzheimer’s disease-like alterations in high-fat diet-fed mice via reactivation of blunted insulin signalling. Kang S, Kim CH, Jung H, Kim E, Song HT, Lee JE. Neuropharmacology. 2017 Feb;113(Pt A):467-479 |
|
23. |
Dietary nitrite reverses features of postmenopausal metabolic syndrome induced by high fat diet and ovariectomy in mice. Ohtake K, Ehara N, Chiba H, Nakano G, Sonoda K, Ito J, Uchida H, Kobayashi J. Am J Physiol Endocrinol Metab. 2017 Feb 14 |
|
24. |
A high-fat diet temporarily renders Sod1-deficient mice resistant to an oxidative insult. Ito J, Ishii N, Akihara R, Lee J, Kurahashi T, Homma T, Kawasaki R, Fujii J. J Nutr Biochem. 2017 Feb;40:44-52. |
|
25. |
Inhibition of Gastric Inhibitory Polypeptide Receptor Signaling in Adipose Tissue Reduces Insulin Resistance and Hepatic Steatosis in High Fat Diet-Fed Mice. Joo E, Harada N, Yamane S, Fukushima T, Taura D, Iwasaki K, Sankoda A, Shibue K, Harada T, Suzuki K, Hamasaki A, Inagaki N. Diabetes. 2017 Jan 17. |
|
26. |
BCL11B gene heterozygosity causes weight loss accompanied by increased energy consumption, but not defective adipogenesis, in mice. Inoue J, Ihara Y, Tsukamoto D, Yasumoto K, Hashidume T, Kamimura K, Hirano S, Shimizu M, Kominami R, Sato R. Biosci Biotechnol Biochem. 2017 Jan 9:1-9. |
|
27. |
Attenuated secretion of glucose-dependent insulinotropic polypeptide (GIP) does not alleviate hyperphagic obesity and insulin resistance in ob/ob mice. Satoko Shimazu-Kuwahara,Norio Harada,Shunsuke Yamane,Erina Joo,Akiko Sankoda,Timothy J. Kieffer,Nobuya Inagaki. Molecular Metabolism,Available online 19 January 2017 |
|
28. |
Dietary Mung Bean Protein Reduces Hepatic Steatosis, Fibrosis, and Inflammation in Male Mice with Diet-Induced, Nonalcoholic Fatty Liver Disease. Watanabe H, Inaba Y, Kimura K, Asahara SI, Kido Y, Matsumoto M, Motoyama T, Tachibana N, Kaneko S, Kohno M, Inoue H. J Nutr. 2017 Jan;147(1):52-60. |
|
29. |
Germinated Pigmented Rice (Oryza Sativa L. cv. Superhongmi) Improves Glucose and Bone Metabolisms in Ovariectomized Rats. Chung SI, Ryu SN, Kang MY. Nutrients. 2016 Oct 21;8(10). |
|
30. |
Angiopoietin-like peptide 4 regulates insulin secretion and islet morphology. Kim HK, Kwon O, Park KH, Lee KJ, Youn BS, Kim SW, Kim MS. Biochem Biophys Res Commun. 2017 Feb 7 |
|
31. |
Ubc13 haploinsufficiency protects against age-related insulin resistance and high-fat diet-induced obesity. Joo E, Fukushima T, Harada N, Reed JC, Matsuzawa SI, Inagaki N. Sci Rep. 2016 Oct 31;6:35983. |
|
32. |
Procyanidin Promotes Translocation of Glucose Transporter 4 in Muscle of Mice through Activation of Insulin and AMPK Signaling Pathways. Yamashita Y, Wang L, Nanba F, Ito C, Toda T, Ashida H. PLoS One. 2016 Sep 6;11(9):e0161704 |
|
33. |
Oxytocin Protects against Stress-Induced Cell Death in Murine Pancreatic β-Cells. Watanabe S, Wei FY, Matsunaga T, Matsunaga N, Kaitsuka T, Tomizawa K. Sci Rep. 2016 May 4;6:25185. |
|
34. |
Loss of circadian rhythm of circulating insulin concentration induced by high-fat diet intake is associated with disrupted rhythmic expression of circadian clock genes in the liver. Honma K, Hikosaka M, Mochizuki K, Goda T. Metabolism. 2016 Apr;65(4):482-91 |
|
35. |
Sodium alginate prevents progression of non-alcoholic steatohepatitis and liver carcinogenesis in obese and diabetic mice. Miyazaki T, Shirakami Y, Kubota M, Ideta T, Kochi T, Sakai H, Tanaka T, Moriwaki H, Shimizu M. Oncotarget. 2016 Mar 1;7(9):10448-58. |
|
36. |
Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Nishimoto S, Fukuda D, Higashikuni Y, Tanaka K, Hirata Y, Murata C, Kim-Kaneyama JR, Sato F, Bando M, Yagi S, Soeki T, Hayashi T, Imoto I, Sakaue H, Shimabukuro M, Sata M. Sci Adv. 2016 Mar 25;2(3):e1501332 |
|
37. |
Fatty Liver and Insulin Resistance in the Liver-Specific Knockout Mice of Mitogen Inducible Gene-6. Park BK, Lee EA, Kim HY, Lee JC, Kim KS, Jeong WH, Kim KY, Ku BJ, Rhee SD. J Diabetes Res. 2016;2016:1632061 |
|
38. |
Reactive sulfur species regulate tRNA methylthiolation and contribute to insulin secretion. Takahashi N, Wei FY, Watanabe S, Hirayama M, Ohuchi Y, Fujimura A, Kaitsuka T, Ishii I, Sawa T, Nakayama H, Akaike T, Tomizawa K. |
|
39. |
Effects of caloric restriction on O-GlcNAcylation, Ca(2+) signaling, and learning impairment in the hippocampus of ob/ob mice. Jeon BT, Heo RW, Jeong EA, Yi CO, Lee JY, Kim KE, Kim H, Roh GS. Neurobiol Aging. 2016 Aug;44:127-37. |
|
40. |
Chronic Repression of mTOR Complex 2 Induces Changes in the Gut Microbiota of Diet-induced Obese Mice. Jung MJ, Lee J, Shin NR, Kim MS, Hyun DW, Yun JH, Kim PS, Whon TW, Bae JW. Sci Rep. 2016 Jul 29;6:30887. |
|
41. |
Single ingestion of soy β-conglycinin induces increased postprandial circulating FGF21 levels exerting beneficial health effects. Hashidume T, Kato A, Tanaka T, Miyoshi S, Itoh N, Nakata R, Inoue H, Oikawa A, Nakai Y, Shimizu M, Inoue J, Sato R. Sci Rep. 2016 Jun 17;6:28183. |
|
42. |
Paraventricular NUCB2/Nesfatin-1 Supports Oxytocin and Vasopressin Neurons to Control Feeding Behavior and Fluid Balance in Male Mice. Nakata M, Gantulga D, Santoso P, Zhang B, Masuda C, Mori M, Okada T, Yada T. Endocrinology. 2016 Jun;157(6):2322-32. |
|
43. |
Oxytocin Protects against Stress-Induced Cell Death in Murine Pancreatic β-Cells. Watanabe S, Wei FY, Matsunaga T, Matsunaga N, Kaitsuka T, Tomizawa K. Sci Rep. 2016 May 4;6:25185. |
|
44. |
Loss of circadian rhythm of circulating insulin concentration induced by high-fat diet intake is associated with disrupted rhythmic expression of circadian clock genes in the liver. Honma K, Hikosaka M, Mochizuki K, Goda T. Metabolism. 2016 Apr;65(4):482-91. |
|
45. |
Protective effect of vitamin E against alloxan-induced mouse hyperglycemia. Takemoto K, Doi W, Masuoka N. Biochim Biophys Acta. 2016 Apr;1862(4):647-50. |
|
46. |
Castration influences intestinal microflora and induces abdominal obesity in high-fat diet-fed mice. Harada N, Hanaoka R, Horiuchi H, Kitakaze T, Mitani T, Inui H, Yamaji R. Sci Rep. 2016 Mar 10;6:23001. |
|
47. |
Pharmacological Inhibition of Monoacylglycerol O-Acyltransferase 2 Improves Hyperlipidemia, Obesity, and Diabetes by Change in Intestinal Fat Utilization. Take K, Mochida T, Maki T, Satomi Y, Hirayama M, Nakakariya M, Amano N, Adachi R, Sato K, Kitazaki T, Takekawa S. PLoS One. 2016 Mar 3;11(3):e0150976. |
|
48. |
GADD34-deficient mice develop obesity, nonalcoholic fatty liver disease, hepatic carcinoma and insulin resistance Naomi Nishio and Ken-ichi Isobe Sci Rep. 2015; 5: 13519. |
|
49. |
Patterns of Brain Activation and Meal Reduction Induced by Abdominal Surgery in Mice and Modulation by Rikkunshito Lixin Wang, Sachiko Mogami, Seiichi Yakabi, Hiroshi Karasawa, Chihiro Yamada, Koji Yakabi, Tomohisa Hattori, and Yvette Taché PLoS One. 2015; 10(9): e0139325. |
|
50. |
Hot water extracts of edible Chrysanthemum morifolium Ramat. exert antidiabetic effects in obese diabetic KK-Ay mice Yamamoto J, Tadaishi M, Yamane T, Oishi Y, Shimizu M, Kobayashi-Hattoria K. Bioscience, Biotechnology, and Biochemistry, Vol.79(7), 2015. |
|
51. |
Dietary obacunone supplementation stimulates muscle hypertrophy, and suppresses hyperglycemia and obesity through the TGR5 and PPARγ pathway. Horiba T, Katsukawa M, Mita M, Sato R. Biochem Biophys Res Commun. Vol.463(4), p846-52, Aug. 2015. |
|
52. |
Hepatic STAMP2 alleviates high fat diet-induced hepatic steatosis and insulin resistance. Kim HY, Park SY, Lee MH, Rho JH, Oh YJ, Jung HU, Yoo SH, Jeong NY, Lee HJ, Suh S, Seo SY, Cheong J, Jeong JS, Yoo YH. J Hepatol. Vol.63(2), p477-85, Aug 2015. |
|
53. |
Optogenetic control of insulin secretion by pancreatic β-cells in vitro and in vivo. Kushibiki T, Okawa S, Hirasawa T, Ishihara M. Gene Ther. Vol.22(7), p553-9, Jul 2015. |
|
54. |
Preventive effects of astaxanthin on diethylnitrosamine-induced liver tumorigenesis in C57/BL/KsJ-db/db obese mice. Ohno T, Shimizu M, Shirakami Y, Miyazaki T, Ideta T, Kochi T, Kubota M, Sakai H, Tanaka T, Moriwaki H. Hepatol Res. Jul 2015 |
|
55. |
Effects of liquid konjac on parameters related to obesity in diet-induced obese mice. Aoe S, Kudo H, Sakurai S. Biosci Biotechnol Biochem. Vol.79(7), p1141-6, Jul 2015. |
|
56. |
Alteration of gut microbiota by vancomycin and bacitracin improves insulin resistance via glucagon-like peptide 1 in diet-induced obesity. Hwang I, Park YJ, Kim YR, Kim YN, Ka S, Lee HY, Seong JK, Seok YJ, Kim JB. FASEB J. Vol.29(6), p2397-411, Jun 2015. |
|
57. |
PRMT4 is involved in insulin secretion via the methylation of histone H3 in pancreatic β cells. Kim JK, Lim Y, Lee JO, Lee YS, Won NH, Kim H, Kim HS. J Mol Endocrinol.Vol.54(3), p315-24, Jun 2015. |
|
58. |
Hepatic NPC1L1 overexpression ameliorates glucose metabolism in diabetic mice via suppression of gluconeogenesis. Kurano M, Hara M, Satoh H, Tsukamoto K. Metabolism. Vol.64(5), p588-96, May 2015. |
|
59. |
Chronic high intake of quercetin reduces oxidative stress and induces expression of the antioxidant enzymes in the liver and visceral adipose tissues in mice. Kobori M, Takahashi Y, Akimoto Y, Sakurai M, Matsunaga I, Nishimuro H, Ippoushi K, Oike H, Ohnishi-Kameyama M. Journal of Functional Foods, Vol.15, p551–560, May 2015. |
|
60. |
Effects of quercetin derivatives from mulberry leaves: Improved gene expression related hepatic lipid and glucose metabolism in short-term high-fat fed mice. Sun X, Yamasaki M, Katsube T, Shiwaku K. Nutr Res Pract. Vol.9(2), p137-43, Apr 2015. |
|
61. |
Insulin Release from the Beta Cells in Acatalasemic Mice Is Highly Susceptible to Alloxan-Induced Oxidative Stress. Kazunori Takemoto, Wakana Doi, Ken Kataoka, Kohji Ishihara, Da-Hong Wang., Hitoshi Sugiyama, Noriyoshi Masuoka. JDM, Vol.5 No.2, May 2015 |
|
62. |
Titanium dioxide nanoparticles increase plasma glucose via reactive oxygen species-induced insulin resistance in mice. Hu H, Guo Q, Wang C, Ma X, He H, Oh Y, Feng Y, Wu Q, Gu N. J Appl Toxicol. Mar 2015 . |
|
63. |
Compensatory hyperinsulinemia in high-fat diet-induced obese mice is associated with enhanced insulin translation in islets. Kanno A, Asahara S, Masuda K, Matsuda T, Kimura-Koyanagi M, Seino S, Ogawa W, Kido Y. Biochem Biophys Res Commun. Vol.13;458(3), p681-6. Mar 2015. |
|
64. |
Optogenetic control of insulin secretion by pancreatic β-cells in vitro and in vivo. Kushibiki T, Okawa S, Hirasawa T, Ishihara M. Gene Ther. Mar 2015. |
|
65. |
Compensatory hyperinsulinemia in high-fat diet-induced obese mice is associated with enhanced insulin translation in islets. Kanno A, Asahara S, Masuda K, Matsuda T, Kimura-Koyanagi M, Seino S, Ogawa W, Kido Y. Biochem Biophys Res Commun. Vol.458(3), p681-6, Mar 2015. |
|
66. |
Essential role of mitochondrial Ca2+ uniporter in the generation of mitochondrial pH gradient and metabolism-secretion coupling in insulin-releasing cells. Quan X, Nguyen TT, Choi SK, Xu S, Das R, Cha SK, Kim N, Han J, Wiederkehr A, Wollheim CB, Park KS. J Biol Chem. Vol.290(7), p4086-96, Feb 2015. |
|
67. |
Endogenous Interleukin 18 Suppresses Hyperglycemia and Hyperinsulinemia during the Acute Phase of Endotoxemia in Mice. Yamashita H, Aoyama-Ishikawa M, Takahara M, Yamauchi C, Inoue T, Miyoshi M, Maeshige N, Usami M, Nakao A, Kotani J. Surg Infect (Larchmt). 2015 Feb;16(1):90-6. |
|
68. |
Hot water extracts of edible Chrysanthemum morifolium Ramat. exert antidiabetic effects in obese diabetic KK-Ay mice. Junpei Yamamoto, Miki Tadaishi, Takumi Yamane, Yuichi Oishi, Makoto Shimizu & Kazuo Kobayashi-Hattoria. Bioscience, Biotechnology, and Biochemistry, Published online: 10 Feb 2015 |
|
69. |
Alteration of gut microbiota by vancomycin and bacitracin improves insulin resistance via glucagon-like peptide 1 in diet-induced obesity. Hwang I, Park YJ, Kim YR1, Kim YN, Ka S, Lee HY, Seong JK, Seok YJ, Kim JB. FASEB J. Feb 2015. |
|
70. |
Titanium dioxide nanoparticles increase plasma glucose via reactive oxygen species-induced insulin resistance in mice. Hu H, Guo Q, Wang C, Ma X, He H, Oh Y, Feng Y, Wu Q, Gu N. J Appl Toxicol. Mar 2015. |
|
71. |
Ashitaba (Angelica keiskei) extract prevents adiposity in high-fat diet-fed C57BL/6 mice. Zhang T, Yamashita Y, Yasuda M, Yamamoto N, Ashida H. Food Funct. Vol.6(1), p134-144, Jan 2015. |
|
72. |
Dietary nitrite supplementation improves insulin resistance in type 2 diabetic KKAy mice Ohtake K, Nakano G, Ehara N, Sonoda K, Ito J, Uchida H, Kobayashi J. Nitric Oxide, Vol.44, p31–38, Jan 2015. |
|
73. |
Salicornia herbacea prevents weight gain and hepatic lipid accumulation in obese ICR mice fed a high-fat diet. Pichiah PT, Cha YS. J Sci Food Agric. Dec 2014. |
|
74. |
Salacia reticulata has therapeutic effects on obesity. Shimada T, Nakayama Y, Harasawa Y, Matsui H, Kobayashi H, Sai Y, Miyamoto K, Tomatsu S, Aburada M. J Nat Med. Vol.68(4), p668-676, Oct 2014.Salicornia herbacea prevents weight gain and hepatic lipid accumulation in obese ICR mice fed a high-fat diet. Pichiah PT1, Cha YS. J Sci Food Agric. Dec 2014. |
|
75. |
Ghrelin administered spinally increases the blood glucose level in mice. Sim Y-B., Park S-H., Kim S-S., Kim C-H., Kim S-J., Lim S-M., Jung J-S., Suh H-W. Peptides, Vol.54, p162-165, Apr 2014.
|
|
76. |
Chronic exposure to valproic acid promotes insulin release, reduces KATP channel current and does not affect Ca2+ signaling in mouse islets. Manaka K., Nakata M., Shimomura K., Rita RS., Maejima Y., Yoshida M., Dezaki K., Kakei M., Yada T. The Journal of Physiological Sciences, Vol.64(1), p77-83, Jan 2014. |
|
77. |
Impaired Lipid and Glucose Homeostasis in Hexabromocyclododecane-Exposed Mice Fed a High-Fat Diet. Yanagisawa R., Koike E., Win-Shwe TT., Yamamoto M. and Takano H. ENVIRONMENTAL HEALTH PERSPECTIVES, Jan 2014. |
|
78. |
Lipid-Lowering Effects of Pediococcus acidilactici M76 Isolated from Korean Traditional Makgeolli in High Fat Diet-Induced Obese Mice. Moon Y-J., Baik S-H. and Cha Y-S. Nutrients, Vol.6(3), p1016-1028, 2014. |
|
79. |
Azilsartan, an angiotensin II type 1 receptor blocker, restores endothelial function by reducing vascular inflammation and by increasing the phosphorylation ratio Ser1177/Thr497 of endothelial nitric oxide synthase in diabetic mice. Matsumoto S., Shimabukuro M., Fukuda D., Soeki T., Yamakawa K., Masuzaki H. and Sata M. Cardiovascular Diabetology, 13:30, 2014. |
|
80. |
Intake of mulberry 1-deoxynojirimycin prevents diet-induced obesity through increases in adiponectin in mice. T.Tsuduki, I.Kikuchi, T.Kimura, K.Nakagawa, T.Miyazawa. Food Chemistry, Vol.139(1-4), p16-23, Aug 2013. |
|
81. |
Chronic treatment with novel GPR40 agonists improve whole-body glucose metabolism based on the glucose-dependent insulin secretion. H.Tanaka, S.Yoshida, H.Oshima, H.Minoura, K.Negoro, T.Yamazaki, S.Sakuda, F.Iwasaki, T.Matsui and M. Shibasaki. JPET, Jul 2013. |
|
82. |
Contribution of insulin signaling to the regulation of pancreatic beta-cell mass during the catch-up growth period in a low birth weight mouse model. Y.Yoshida, M.Fuchita, M.Kimura-Koyanagi, A.Kanno, T.Matsuda, S.Asahara, N.Hashimoto, T.Isagawa, W.Ogawa, H.Aburatani, T.Noda, S.Seino, M.Kasuga, Y.Kido. Diabetology International, Jul 2013. |
|
83. |
Differential contribution of insulin and amino acids to the mTORC1-autophagy pathway in the liver and muscle. T.Naito, A.Kuma and N.Mizushima. The Journal of Biological Chemistry, Jun 2013. |
|
84. |
Apelin Inhibits Diet-Induced Obesity by Enhancing Lymphatic and Blood Vessel Integrity. M.Sawane, K.Kajiya, H.Kidoya, M.Takagi, F.Muramatsu and N.Takakura. Diabetes, Vol.62(6), p1970-1980, Jun 2013. |
|
85. |
Ras-related C3 botulinum toxin substrate 1 (RAC1) regulates glucose-stimulated insulin secretion via modulation of F-actin. S.Asahara, Y.Shibutani, K.Teruyama, H.Y.Inoue, Y.Kawada, H.Etoh, T.Matsuda, M.Kimura-Koyanagi, N.Hashimoto, M.Sakahara, W.Fujimoto, H.Takahashi, S.Ueda, T.Hosooka, T.Satoh, H.Inoue, M.Matsumoto, A.Aiba, M.Kasuga, Y.Kido. Diabetologia, Vol.56(5), p1088-1097, May 2013. |
|
86. |
Effects of hydrophilic statins on renal tubular lipid accumulation in diet-induced obese mice. K.Gotoh, T.Masaki, S.Chiba, H.Ando, K.Fujiwara, T.Shimasaki, Y.Tawara, I.Toyooka, K.Shiraishi, K.Mitsutomi, M.Anai, E.Itateyama, J.Hiraoka, K.Aoki, N.Fukunaga, T.Nawata, T.Kakuma. Obesity Research & Clinical Practice, May 2013. |
|
87. |
Amyloid-β Induces Hepatic Insulin Resistance In Vivo via JAK2. Y.Zhang, B.Zhou, B.Deng, F.Zhang, J.Wu, Y.Wang, Y.Le and Q.Zhai. Diabetes, Vol.62(4), p1159-1166, Apr 2013. |
|
88. |
Histidine augments the suppression of hepatic glucose production by central insulin action Kimura K, Nakamura Y, Inaba Y, Matsumoto M, Kido Y, Asahara S, Matsuda T, Watanabe H, Maeda A, Inagaki F, Mukai C, Takeda K, Akira S, Ota T, Nakabayashi H, Kaneko S, Kasuga M and Inoue H. Diabetes, Vol.62(4), p1003-1004, Apr 2013 |
|
89. |
Improved transplantation outcome through delivery of DNA encoding secretion signal peptide-linked glucagon-like peptide-1 into mouse islets Chae H Y, Lee M, Hwang H J, Kim H A, Kang J G, Kim C S, Lee S J, Ihm S-H. Transplant International, Vol.26(4), p443-452, Apr 2013. |
|
90. |
Histidine augments the suppression of hepatic glucose production by central insulin action K.Kimura, Y.Nakamura, Y.Inaba, M.Matsumoto, Y.Kido, S.Asahara, T.Matsuda, H.Watanabe, A.Maeda, F.Inagaki, C.Mukai, K.Takeda, S.Akira, T.Ota, H.Nakabayashi, S.Kaneko, M.Kasuga and H.Inoue. Diabetes, Mar 2013. |
|
91. |
Wogonin ameliorates hyperglycemia and dyslipidemia via PPARα activation in db/db mice without adverse side effects. Bak E-J, Kim J-H, Lee D-E, Choi Y-H, Kim J M, Woo G-H, Cha J-H, Yoo Y-J. Clinical Nutrition, Available online 26, Mar 2013. |
|
92. |
Extracellular Signal-Regulated Kinase in the Ventromedial Hypothalamus Mediates Leptin-Induced Glucose Uptake in Red-Type Skeletal Muscle. Toda C, Shiuchi T, Kageyama H, Okamoto S, Coutinho E A, Sato T, Okamatsu-Ogura Y, Yokota S, Takagi K, Tang L, Saito K, Shioda S and Minokoshi Y. Diabetes Mar 2013. |
|
93. |
Effect of vitamin E on alloxan-induced mouse diabetes. Kamimura W, Doi W, Takemoto K, Ishihara K, Wang D-H, Sugiyama H, Oda S, Masuoka N. Clinical Biochemistry, Mar 2013. |
|
94. |
Ablation of Rnf213 retards progression of diabetes in the Akita mouse. Kobayashi H, Yamazaki S, Takashima S, Liu W, Okuda H, Yan J, Fujii Y, Hitomi T, Harada K H, Habu T, Koizumi A. Biochemical and Biophysical Research Communications, Vol.432(3), p519-525, Mar 2013.
|
|
95. |
Hypothalamic ATF3 is involved in regulating glucose and energy metabolism in mice. Lee Y-S, Sasaki T, Kobayashi M, Kikuchi O, Kim H-J, Yokota-Hashimoto H, Shimpuku M, Susanti V-Y, Ido-Kitamura Y, Kimura K, Inoue H, Tanaka-Okamoto M, Ishizaki H, Miyoshi J, Ohya S, Tanaka Y, Kitajima S, Kitamura T. Diabetologia, Mar 2013. |
|
96. |
Ras-related C3 botulinum toxin substrate 1 (RAC1) regulates glucose-stimulated insulin secretion via modulation of F-actin. S. Asahara, Y. Shibutani, K. Teruyama, H. Y. Inoue, Y. Kawada, H. Etoh, T. Matsuda, M. Kimura-Koyanagi, N. Hashimoto, M. Sakahara, W. Fujimoto, H. Takahashi, S. Ueda, T. Hosooka, T. Satoh, H. Inoue, M. Matsumoto, A. Aiba, M. Kasuga, Y. Kido. Diabetologia, Feb 2013. |
|
97. |
Toll-like receptor 2 and palmitic acid cooperatively contribute to the development of nonalcoholic steatohepatitis through inflammasome activation in mice. Miura K, Yang L, Rooijen N, Brenner D A, Ohnishi H, Seki E. Hepatology, Vol.57(2), p577-589, Feb 2013. |
|
98. |
Transcriptional Regulatory Factor X6 (Rfx6) Increases Gastric Inhibitory Polypeptide (GIP) Expression in Enteroendocrine K-cells and Is Involved in GIP Hypersecretion in High Fat Diet-induced Obesity*. K.Suzuki, N.Harada, S.Yamane, Y.Nakamura, K.Sasaki, D.Nasteska, E.Joo, K.Shibue, T.Harada, A.Hamasaki, K.Toyoda, K.Nagashima and N.Inagaki. The Journal of Biological Chemistry, Vol.288, p1929-1938, Jan 2013. |
|
99. |
Improved hypothermic short-term storage of isolated mouse islets by adding serum to preservation solutions. Yasuko Kimura, Teru Okitsu, Liu Xibao, Hiroki Teramae, Atsuhito Okonogi, Kentaro Toyoda, Shinji Uemoto and Masanori Fukushima. Islets, Vol.5(1), Jan 2013. |
|
100. |
Anti-diabetic effect of amorphastilbol through PPARα/γ dual activation in db/db mice. Lee W, Ham J, Kwon H C, Kim Y K, Kim S-N. Biochemical and Biophysical Research Communications, Jan 2013. |
|
101. |
Transcriptional Regulatory Factor X6 (Rfx6) Increases Gastric Inhibitory Polypeptide (GIP) Expression in Enteroendocrine K-cells and Is Involved in GIP Hypersecretion in High Fat Diet-induced Obesity. Suzuki K, Harada N, Yamane S, Nakamura Y, Sasaki K, Nasteska D, Joo E, Shibue K, Harada T, Hamasaki A,Toyoda K, Nagashima K and Inagaki N. The Journal of Biological Chemistry, Vol.288, p1929-1938, Jan 2013. |
|
102. |
Apelin inhibits diet-induced obesity by enhancing lymphatic and blood vessel integrity. Sawane M, Kajiya K, Kidoya H, Takagi M, Muramatsu F and Takakura N. Diabetes, 2013. |
|
103. |
Beneficial effects of Allium sativum L. stem extract on lipid metabolism and antioxidant status in obese mice fed a high fat diet. Kim I, Kim H-R, Kim J-H, Om A-S. Journal of the Science of Food and Agriculture, 2013. |
|
104. |
Intake of mulberry 1-deoxynojirimycin prevents diet-induced obesity through increases in adiponectin in mice. Tsuduki T, Kikuchi I, Kimura T, Nakagawa K, Miyazawa T. Food Chemistry, Vol.139(14), p16-23, 2013. |
|
105. |
Effect of Mukitake mushroom (Panellus serotinus) on the pathogenesis of lipid abnormalities in obese, diabetic ob/ob mice. Inoue N, Inafuku M, Shirouchi B, Nagao K and Yanagita T. Lipids in Health and Disease, Vol.12(18), 2013. |
|
106. |
Pax6 Directly Down-Regulates Pcsk1n Expression Thereby Regulating PC1/3 Dependent Proinsulin Processing. Liu T., Zhao Y., Tang N., Feng R., Yang X., Lu N., Wen J., Li L. PLOS ONE, Vol.7(10), Oct 2012. |
|
107. |
Anti-Diabetic Atherosclerosis Effect of Prunella vulgaris in db/db Mice with Type 2 Diabetes. Hwang S M, Kim J K, Lee Y J, Yoon J J, Lee S M, Kang D G, Lee H S. Am J Chin Med, Vol.40, 2012. |
|
108. |
Prevention mechanisms of glucose intolerance and obesity by cacao liquor procyanidin extract in high-fat diet-fed C57BL/6 mice. Y. Yamashita., M. Okabe., M. Natsume., H. Ashida. Archives of Biochemistry and Biophysics, Available online 23 March 2012, In Press |
|
109. |
The Action of D-Dopachrome Tautomerase as an Adipokine in Adipocyte Lipid Metabolism. T. Iwata., H. Taniguchi., M. Kuwajima., T. Taniguchi., Y. Okuda., A. Sukeno., K. Ishimoto., N. Mizusawa., K. Yoshimoto. PLos ONE, Vol. 7(3), Mar 2012. |
|
110. |
Soymorphin-5, a soy-derived μ-opioid peptide, decreases glucose and triglyceride levels through activating adiponectin and PPARα systems in diabetic KKAy mice. Y. Yamada.,.A. Muraki.,.M. Oie.,.N. Kanegawa.,.A. Oda., Y. Sawashi., K. Kaneko., M. Yoshikawa., T. Goto., N. Takahashi., T. Kawada., and K. Ohinata. American Physiological Society, Vol.302, No.4, E433-E440, 2012. |
|
111. |
Effects of Gametophytes of Ecklonia Kurome on the Levels of Glucose and Triacylglycerol in db/db, Prediabetic C57BL/6J and IFN-γ KO Mice. F. Dwiranti., M. Hiraoka., T. Taguchi., Y. Konishi., M. Tominaga., A. Tominaga. Int J B 64 iomed Sci, Vol.8, No.1, Mar 2012. |
|
112. |
Endoplasmic Reticulum Stress Inhibits STAT3-Dependent Suppression of Hepatic Gluconeogenesis via Dephosphprylation and Deacetylation. K. Kimura., T. Yamada., M. Matsumoto., Y. Kido., T. Hosooka., S. Asahara., T. Matsuda., T. Ota., H. Watanabe., Y. Sai., K. Miyamoto., S. Kaneko., M. Kasuga., H. Inoue. Diabetes, Vol.61, No.1, p61-73, 2012. |
|
113. |
Melatonin protects mice with intermittent hypoxia from oxidative stress-induced pancreatic injury. LI G., HOU G., LU W., KANG J. Sleep and Biological Rhythms, Vol.9(2), p78-85, Apr 2011. |
|
114. |
A novel dipeptidyl peptidase IV inhibitor DA-1229 ameliorates streptozotocin-induced diabetes by increasing β-cell replication and neogenesis. J, M, Cho., H, W, Jang., H, Cheon.,Y, T, Jeong., D-H, Kim., Y-M, Lim., S, Choi., E, Yang., C-Y, Shin., M, H, Son., S, H, Kim., H, Kim., M, Lee. Diabetes Research and Clinical Practice.Vol. 91(1), p72-79, 2011. |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 634-01481 | (AKRIN-011T)LBIS® Insulin-Mouse-T | 96 tests | – | – |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
细胞凋亡 M30 Apoptosense® ELISA试剂盒 M30 Apoptosense® ELISA
细胞凋亡 M30 Apoptosense® ELISA试剂盒
M30 Apoptosense® ELISA
- 产品特性
- 相关资料
- Q&A
- 参考文献
细胞凋亡M30 Apoptosense® ELISA试剂盒![]()
M30 Apoptosense® ELISA
◆原理
M30 Apoptosense® ELISA 是 PEVIVA 的畅销产品。可用于定量检测表达角蛋白18(K18)细胞(人)的凋亡情况。检测结果可信度高,检测结果重复性好。特异性检测可信度高是因为 M30 Apoptosense® ELISA 只单独检测可溶性 caspase-cleaved 角蛋白18(细胞凋亡产物)。
该产品广泛运用于肝脏疾病,肿瘤,毒理学等研究领域。
M30 Apoptosense® ELISA 可用于检测人血清,并且带有 CE 标记(可用于体外诊断)。所有试剂都是即用型的。

◆优点・特色
● 特异性定量检测表达角蛋白18细胞的细胞凋亡,包括肝细胞,乳腺癌、肺癌、前列腺癌、结肠癌等上皮细胞来源的肿瘤细胞。
● 可用于早期凋亡研究,比常规的 Annexin V 检测灵敏度高。可检测血清、血浆和细胞培养上清的样品。常规检测细胞凋亡,需要制备细胞裂
解液,取材不方便。
● 可检测多种 caspase 介导的细胞凋亡(比如 caspase-3,-7,-9)
● 夹心 ELISA 法进行检测,96 孔板,板子可拆卸。试剂即拆即用。
● 与M65® ELISA 配套使用,定量检测细胞凋亡、细胞坏死和总细胞死亡。
● 肝脏疾病:定量检测患肝脏疾病病人的肝细胞凋亡情况,可预测患肝脏疾病的可能性。
● 肿瘤:监测上皮细胞肿瘤患者化疗诱导肿瘤细胞凋亡的情况。
● 毒理学:临床评估不同药物对肝脏细胞的毒性。

M30 Apoptosense® 是基于M30单抗的ELISA试剂盒(Leers et al., 1999)。 该抗体可以特异性结合 caspase-cleaved 角蛋白18(ccK18、caspase-celaved cytokeratin 18、ccCK18 或者 K18-Asp396)。caspase 水解角蛋白18形成3个片段,其中1个片段氨基酸第 387 位-第 396 位含有新表位(neoeptitope),这个片段就称为 caspase-cleaved 角蛋白),但是不结合天然、未切除的 K18。 M30 Apoptosense® 因此可特异性检测上皮细胞的凋亡情况(Hägg et al. 2002)。
◆案例・应用
● 监测肿瘤治疗
人经常患的肿瘤包括肺癌,乳腺癌,前列腺癌和结肠癌。这些肿瘤细胞起源于上皮细胞,并且表达 K18。肿瘤治疗过程中肿瘤细胞发生凋亡,K18被水解后释放到细胞外和血液中。相比较而言,其他类型细胞比如淋巴细胞化疗后细胞发生凋亡不会产生 K18 片段。 Caspase-cleaved CK18 因此成为理想的血液型细胞凋亡标记物。进来研究发现接受不同治疗方案的肿瘤患者,其血清中的 caspase-cleaved K18(ccK18, K18Asp396-NE 或者 M30新表位)有所提高(Kramer et al., 2004; Kramer et al., 2006)。这个提升与临床治疗有关。(Olofsson et al., 2007, Scott et al., 2009, Hou et al., 2009)
● 肝脏疾病
肝细胞表达 K18。在涉及细胞凋亡的肝脏疾病比如肝纤维化、肝脏损伤中 K18 发生水解,导致组织中 M30 表位暴露(Bantel et al. 2001)。患有肝细胞凋亡相关的疾病包括丙肝病毒感染(Bantel et al., 2004),乙肝病毒感染(Papatheodoridis et al., 2008),非酒精的脂肪肝(NASH)(Wieckowska et al. 2006),毒剂相关脂肪肝(NASH)(Cave et al., 2010),胆道炎症和严重胆汁郁结(Yagmur et al., 2007)的患者,其血液循环中可溶性 caspase-cleaved K18-Asp396 片段升高。
● 其他运用
由细胞凋亡引起细胞死亡的其他疾病。检测 caspase-cleaved K18 片段证实可用于严重白血病患者的早期预测(Hofer et al., 2009)。
M30 Apoptosense® ELISA 可用于监测器官移植的病人(Luft et al., 2007),也可用于肝脏移植期间 caspase 抑制剂的临床实验(Baskin‑Bey et al., 2007)。
◆产品信息
M30-Apoptosense® ELISA kit (CE-Mark)
在体内外实验中定量检测上皮细胞的凋亡。使用血浆样品,可以特异性定量检测小鼠模型中人的异种移植物的凋亡情况。
|
特异性 |
人 |
|
样品类型 |
含有从凋亡上皮细胞中释放的 CK18 的血清或者血浆(EDTA、citrate、heparin plasma);含有 CK18 阳性的凋亡细胞或者组织的细胞裂解液或者上清 |
|
灵敏度 |
25 U/L,Standard A (0U/L)+ 2 S.D. |
|
范围 |
75-1,000 U/L |
|
检测目标物 |
可溶性 caspase 酶解的 CK18 |
| 特点 |
可进行定量检测;试剂盒中包含两个阳性对照;预铺 ELISA 板(可拆卸)、即用试剂,操作方便;可用于自动化 |
更多运用案例
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 10011 | M30 Apoptosense® ELISA 细胞凋亡M30 Apoptosense ® ELISA试剂盒 |
96 wells | – | – |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
IL-33 (人), ELISA 试剂盒 IL-33 (human), ELISA kit
IL-33 (人), ELISA 试剂盒
IL-33 (human), ELISA kit
- 产品特性
- 相关资料
- Q&A
- 参考文献
IL-33(释放于坏死细胞)动员杀伤性T细胞应对病毒感染![]()
◆原理
细胞死亡后会释放一类特殊的蛋白质 Alarmin(暂译为警报素),通过检测 Alarmin 可识别组织创伤。然而在抗病毒免疫系统中,Alarmin 所起的作用不是很明确。最近瑞士日内瓦大学和德国柏林夏里特医科大学研究人员发现在脾脏和淋巴结中病毒的复制可导致受感染的细胞死亡。这些坏死的细胞可释放出 Alarmin,其中主要的是白介素-33(IL-33),它可通过 ST2 受体激活 CD8+ T(CTLs)细胞,对病毒感染作出反应。研究发现缺乏 IL-33 的小鼠,CTL 对病毒感染的免疫反应也较低。此项研究具有里程碑意义,因为提出了一个新的免疫机制:坏死细胞会释放出 Alarmin 动员杀伤性T细胞应对感染,在未来对抗艾滋、丙型肝炎而开发新的疫苗,对于癌症治疗有重要作用。
Enzo Life Sciences 提供大量细胞坏死研究用产品,先天性免疫适应性免疫等。许多与 Alarmin IL-33 有关,供科研人员选择。
◆优点・特色
|
产品名称 |
特点 |
|
IL-33 (human), ELISA kit |
Reliably measure as little as 1.7 pg/mL of IL-33 |
|
IL-33 (mouse) ELISA Kit |
Reliably measure as little as 10pg/mL of IL-33 |
|
IL-33 soluble (human), detection set |
Reliably measure as little as 5pg/mL of IL-33 |
|
GFP-Certified™ Apoptosis/Necrosis detection kit |
Cell-based assay for microscopy and flow cytometry |
|
IL-33 (human), (recombinant) |
≥95% pure (SDS-PAGE) |
|
IL-33 (human), (recombinant) |
≥95% pure (SDS-PAGE), FLAG-tag |
|
IL-33 (human), (recombinant) |
≥95% pure (SDS-PAGE), His-tag |
|
Pro-IL-33 (human), (recombinant) |
≥90% pure (SDS-PAGE), His-tag |
|
IL-33 (human) (homeodomain-like helix-turn-helix), (recombinant) |
Human IL-33 homeodomain, fused at C- terminus to His-tag, ≥95% pure (SDS-PAGE) |
|
IL-33 (mouse), (recombinant) |
≥95% pure (SDS-PAGE) |
|
IL-33 (mouse), (recombinant) |
≥95% pure (SDS-PAGE), His-tag |
|
IL-33 (rat), (recombinant) |
≥95% pure (SDS-PAGE) |
|
IL-33 (human), mAb |
Suitable for ELISA, IHC, IP, WB (clone IL33305B) |
|
IL-33 (human), pAb |
Suitable for ELISA, WB |
|
IL-33 (human), pAb |
Suitable for ELISA, WB, Biotin conjugate |
|
IL-33 (mouse), pAb |
Suitable for ELISA, WB |
|
IL-33, mAb |
Recognizes human and mouse IL-33. ELISA, IP, WB.(clone IL33026B) |
|
IL-33, mAb |
Recognizes human IL-33. Weakly cross-reacts with mouse IL-33. ELISA, WB. (clone IL33068A) |
|
IL-33, mAb |
Recognizes human, mouse and rat pro-IL-33 (precursor) and mature IL-33. ELISA, IHC, IHC, IP, WB (clone Nessy-1) |
|
IL-33, mAb |
Biotin-conjugate (clone Nessy-1) |
|
IL-33, mAb |
Preservative free, (clone Nessy-1) |
|
IL-33, mAb |
ICC, WB (clone Nessy-2) |
|
IL-33, pAb (AT110) |
Recognizes human, mouse and rat pro-IL-33 and mature IL-33, ELISA, WB |
|
IL-33, pAb (AT110) |
Biotin-conjugate |
|
ST2 (human), (recombinant) |
≥90% pure (SDS-PAGE) |
|
ST2 (human), mAb |
ELISA, IHC, IHC, WB (clone ST33868) |
|
ST2 (human):Fc (human), (recombinant) |
≥90% pure (SDS-PAGE) |
|
ST2 (mouse):Fc (human), (recombinant) |
≥95% pure (SDS-PAGE) |
|
IL-1RAcP (human):Fc (human) (recombinant) |
Forms heterodimer complex with ST2 to make the IL-33 receptor. ≥95% pure (SDS-PAGE) |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| ADI-900-201 | IL-33 (human), ELISA kit IL-33 (人), ELISA试剂盒 |
96wells等 | – | – |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
催产素ELISA试剂盒 Oxytocin ELISA Kit Wako
催产素ELISA试剂盒
Oxytocin ELISA Kit Wako
- 产品特性
- 相关资料
- Q&A
- 参考文献
催产素ELISA试剂盒
Oxytocin ELISA Kit Wako
催产素(Oxytocin)是一种由9个氨基酸组成的肽类激素,由下丘脑产生,在分娩和哺乳期间主要由垂体后叶释放,具有促进子宫收缩和母乳分泌的作用。催产素还具有缓解压力和抗焦虑/抗恐惧的作用,参与母性行为的形成,因此俗称“幸福激素”或“爱情激素”。这种分子在治疗抑郁症和自闭症等精神疾病以及开发功能材料中备受瞩目。然而目前,对催产素检测方法存在需使用C18柱进行前处理,步骤复杂、需要大量样品等问题。
Oxytocin ELISA Kit Wako
Oxytocin ELISA Kit Wako 是可定量样品中催产素的 ELISA 试剂盒。样品前处理步骤简单,只需混合试剂、搅拌、离心即可完成前处理;样品的最低所需量为 50 μL,克服了传统催产素检测方法中的难题。
◆特点
● 前处理简便
进行样品前处理时,只需添加试剂盒中的前处理液、搅拌、离心。无需 C18 柱或有机溶剂。
● 使用少量样品即可检测
样品最低所需量:50 μL(n=1)
● 检测时间短
检测时间为 2.5 h。前处理可在约 30 min 内完成。
● 兼容多种样品
兼容人唾液/尿/血清/血浆、小鼠·大鼠血清/血浆
【注意事项】
本试剂盒采用了高灵敏度的竞争法,需要使用微孔板振荡器和发光检测用的酶标仪。
使用本试剂盒进行合同服务或需取得相关许可。详情请联系我司。
◆试剂盒性能
◆标准曲线示例
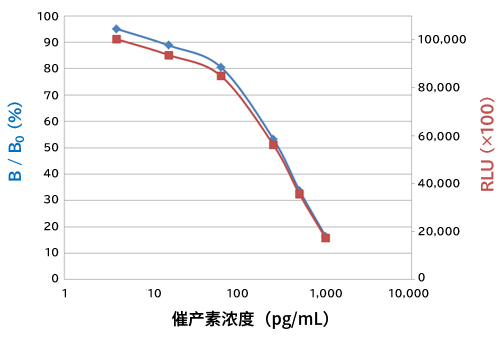
◆检测原理
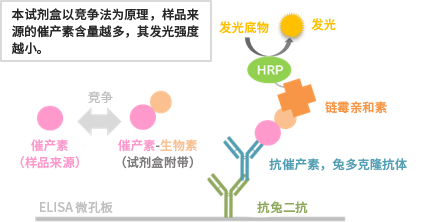 |
①抗催产素、兔多克隆抗体-抗兔二抗已预先固定在检测板各孔中; ②将生物素结合催产素溶液和标准溶液或经过前处理的样品放入板 孔中,使其发生竞争反应; ③使生物素与HRP结合链霉亲和素反应; ④添加HRP用发光底物; ⑤通过检测孔中的HRP活性(发光强度)来测量样品中催产素的浓度。 |
◆样品前处理方法的比较
|
本产品的前处理法(约 30 min,回收率:90-120%) 样品(唾液/尿/血清/血浆) ↓ 添加样品前处理液1 ↓ 搅拌后、室温静置 10 min(5 min 后搅拌一次) ↓ 添加样品前处理液2 ↓ 搅拌后,室温静置 10 min(5 min 后搅拌一次) ↓ 离心分离 ↓ 分离上清,作为检测用样品 |
E公司的前处理法(约 2~4 h,回收率:42-110%) 样品(唾液/尿/血清/血浆) ↓ 添加TFA,混合 ↓ 离心分离 ↓ 将上清添加至经TFA、乙腈平衡的C18色谱柱中 ↓ 用TFA清洗,用乙腈洗脱 ↓ 对洗脱出的样品减压、干燥 ↓ 用缓冲液溶解,作为检测用样品 |
◆试剂盒组成
|
96 tests |
|
抗体固定板 1 块 |
|
催产素标准品 100 μL |
|
缓冲液 60 mL |
|
生物素结合催产素 1支 |
|
过氧化物酶结合链霉亲和素溶液 100 μL |
|
发光试剂1 6 mL |
|
发光试剂2 6 mL |
|
清洗液(10×) 100 mL |
|
样品前处理液1 5mL |
|
样品前处理液2 12 mL |
|
封板膜 4张 |
◆数据
添加回收测试
人样品
小鼠样品
大鼠样品
◆产品列表
◆相关产品
样品相关
Q:可检测的样本有哪些?
A:经确认可检测的样品有:人唾液/血清/血浆/尿、小鼠血清/血浆、大鼠血清/血浆。
Q:所需样品量是多少?
A:n=1 时,样品的最低所需量为 50 μL。对于小鼠血清/血浆,使用试剂盒中的缓冲液稀释至2倍、4倍即可检测。
n=2 时,推荐样品量为 200 μL。
检测对象相关
Q:与抗利尿激素的交叉性如何?
A:与[Arg8]-抗利尿激素的交叉性约为2.9%。
Q:可以检测中催产素(Mesotocin)、硬骨鱼催产素(Isotocin)和血管舒缩素(Basotocin)吗?
A:暂无相关数据。
抗体相关
Q:可以单独购买这个试剂盒中的抗体吗?
A:试剂盒中的抗体不作单独销售。
试剂盒的使用相关
Q:使用这个试剂盒进行检测时,需要哪些试剂、仪器和设备?
A:本试剂盒采用了高灵敏的竞争法,需要振荡仪和发光检测用的酶标仪。以下为使用本试剂盒时需要使用的试剂、仪器、设备。
● 纯净水(蒸馏水)
● 标准溶液/样品稀释用试管
● 清洗液稀释用玻璃容器(量筒、烧杯)
● 移液器及其一次性枪头(可准确移液 10 μL 以及 200-500 μL)
● 连续移液器(可连续移液 100 μL)
● 纸巾等吸水材料(清洗后去除板上残留的液体)
● 涡旋振荡器
● 微量板振荡器(约 600~800 rpm)
● 96 孔板用的洗涤仪器(可选,非必须)或洗瓶
● 96 孔板酶标仪(发光检测用)
● 数据处理软件
Q:使用这个试剂盒可以提供定制服务吗?
A:使用本试剂盒进行合同服务或需获得相关许可,详情请向我司咨询。
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
Erythroferrone(人)ELISA试剂盒 市面上为数不多的特异性&灵敏检测
Erythroferrone(人)ELISA试剂盒
市面上为数不多的特异性&灵敏检测
Erythroferrone(又称为 Myonectin(肌联素)、CTRP15、Fam13B 或 ERFE)是一种在骨髓中由幼红细胞产生的激素,以响应促红细胞生成素对铁元素储存释放的控制;或通过运动,Myonectin 在骨骼肌组织中大量表达。另外,Erythroferrone/肌联素是一种潜在的临床生物标志物,可用于评估血液疾病患者的红细胞生成,研究铁稳态以保护心血管/心脏,并且有可能用于调节代谢紊乱。
NEW Erythroferrone(人)ELISA 试剂盒
Erythroferrone(人)ELISA 试剂盒(AG-45B-0014)采用了双抗体夹心法,用于体外定量检测细胞培养上清液、血清和血浆中的人 Erythroferrone。

◆特点
√ 高特异性
√ 高灵敏度
√ 高再现性
√ 经过大量样品测试和验证
√ 瑞士品质保证
此外,还可提供 Erythroferrone(人)匹配对检测套装(产品编号:AG-46B-0012)
备注:产品AG-45B-0014 和AG-46B-0012基于相同的匹配抗体对!关于与样品稀释相关检测值的更多建议,请参考以下文献。
参考文献:Erythroferrone as a sensitive biomarker to detect stimulation of erythropoiesis: K. Ramirez Cuevas, et al.; Drug Test. Anal . 12, 261 (2019)
◆关于 Erythroferrone/肌联素
Erythroferrone(又称为肌联素、CTRP15 或 Fam13B)是 CTRPs(C1q/TNF相关蛋白)的成员之一,也是含有胶原样区和C1q样球状结构域的保守脂联素旁系同源物。可发挥以下两种不同的调节作用(见下图):
Ⅰ)Erythroferrone(在此作用中被称为 Myonectin,肌联素)是一种在骨骼肌组织中大量表达的肌细胞因子,可通过主动锻炼上调其表达,通过禁食可抑制、再进食可诱导;通过促进循环中非酯化脂肪酸(NEFA)的清除,参与全身脂质代谢的调节;作为一种肌细胞因子,肌联素充当驱动耐力训练的肌细胞因子,通过减少心肌细胞的凋亡和巨噬细胞的炎症反应,保护心脏免受缺血性损伤。
Ⅱ)Erythroferrone 在出血或经促红细胞生成素(EPO)治疗后,由幼红细胞生成,作用于肝细胞以抑制铁调素表达,使铁从细胞铁储存中的释放增多。Erythroferrone 通过抑制BMP-5、BMP-6和BMP-7亚群的成员,作用于铁调素。Erythroferrone 对铁调素的抑制使铁转运蛋白(目前已知的铁输出)介导血浆中储存在肠道、脾脏和肝脏中的铁的释放成为可能,作为铁代谢和血红蛋白合成的红细胞调节剂发挥着作用。铁代谢(包括铁调素和 Erythroferrone)与病毒感染(入侵、复制)密切相关,或许将会是一个抗病毒靶点(如SARS-CoV-2)。
本 ELISA 试剂盒在血清和血浆中测定的 ERFE 水平与在小鼠中测定的ERFE蛋白水平接近(约500 ng/mL)。我们的 Erythroferrone 检测试剂盒已在瑞士兴奋剂分析实验室(the Swiss Laboratory for Doping Analyses)近期出版的刊物中得到验证,其报告显示本检测试剂盒可以灵敏地检测红细胞生成的刺激,包括红细胞生成刺激剂(ESA,如促红细胞生成素)的滥用和抽血。Erythroferrone 是不同类型贫血、心脏病学和代谢疾病的生物标志物。

图:Erythroferrone/肌联素的不同作用。
◆产品参考文献
1. Erythroferrone as a sensitive biomarker to detect stimulation of erythropoiesis: K. Ramirez Cuevas, et al.; Drug Test. Anal. 12, 261 (2020)
>>>该文献中使用的抗体匹配对与本ELISA试剂盒中所用的相同!
◆产品详情
|
别称 |
CTRP15;补体C1q肿瘤坏死因子相关蛋白15;肌联素;FAM132B;ERFE |
|
产品类型 |
试剂盒 |
|
应用 |
ELISA定量检测 |
|
特异性 |
检测血清、血浆和细胞培养上清液中的人ERFE【肌联素;CTRP15】 |
|
交叉反应 |
人 |
|
包装 |
1×96 wells |
|
灵敏度 |
270 pg/mL |
|
检测范围 |
0.3125 ~ 20 ng/mL |
|
样品类型 |
· 细胞培养上清液 · 血浆 · 血清 |
|
分析方法 |
夹心法 |
|
检测方法 |
比色法 |
|
其他产品数据 |
UniProt link Q4G0M1: Erythroferrone (human) |
|
运输方式 |
蓝冰 |
|
存放温度 |
+4°C |
|
存放建议 |
· 标准品溶解后分装,并存放于-20°C下。 · 避免反复冻融。 · 96孔板、试剂在使用前应恢复到室温。 |
|
使用/稳定性 |
自生产后12个月。见试剂盒上注明的有效期。 |
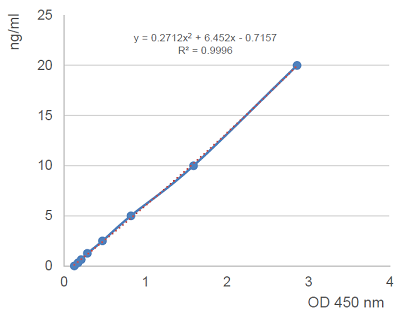
重要提示:Erythroferrone/肌联素水平和样品稀释
Erythroferrone/肌联素已被证实在肌肉(称为 Myonectin/CTRP15)或幼红细胞(称为 Erythroferrone/ERFE)中表达。基于大量的内部验证并根据 K. Ramirez Cuevas, et al.; Drug Test. Anal.(2019)在未稀释样品中的检测值,对于使用 ERFE(人)ELISA 试剂盒和匹配对检测试剂盒,提供如下建议:
1. 若要检测促红细胞生成素(EPO)治疗或输血后ERFE的增加,请使用未稀释或低稀释的血清/血浆(约1/10):
> 检测值范围为2-4 ng/mL至15-25 ng/mL。
2. 若要检测ERFE的稳态水平,请使用稀释血清(> 1/150):
> 数值范围为300 ng/mL至>1200 ng/mL。
注意:有关上述结果的解释以及与建议相关的更多信息,请下载说明和数据。
◆产品列表
|
产品编号 |
产品名称 |
包装 |
|
AG-45B-0014-KI01 |
Erythroferrone (human) ELISA Kit |
96 wells |
◆其他铁代谢相关试剂
|
产品编号 |
产品名称 |
包装 |
特异性 |
检测范围 |
样品 |
|
JAI-CFE-005 |
Iron Colorimetric Assay Kit (Ferrozine Method) |
100 tests |
Fe2+和Fe3+ |
5-1’000 μg/dL |
细胞裂解液、血浆、唾液、血清、组织上清液、尿液 |
|
JAI-CFE-010 |
Iron Colorimetric Assay Kit (Nitroso-PSAP Method) |
100 tests |
Fe2+和Fe3+ |
10-1’000μg/dL |
细胞裂解液、血浆、唾液、血清、组织上清液、尿液 |
|
产品编号 |
产品名称 |
包装 |
来源 |
内毒素 |
类型 |
|
CHI-HF-220EPO |
EPO (human):Fc (human) (rec.) (non-lytic) |
50 µg |
CHO细胞 |
<0.06 EU/μg 蛋白 |
人 |
※ 本页面产品仅供研究用,研究以外不可使用。
参考文献
|
1. |
Myonectin (CTRP15), a novel myokine that links skeletal muscle to systemic lipid homeostasis: M.M. Seldin, et al.; J. Biol. Chem. 287, 11968 (2012)
|
|
2. |
Identification of Erythroferrone as an Erythroid Regulator of Iron Metabolism: L. Kautz, et al; Nat. Genet. 46, 678 (2014)
|
|
3. |
Is erythroferrone finally the long sought-after systemic erythroid regulator of iron? A. Lawen; World. J. Biol. Chem. 6, 78 (2015)
|
|
4. |
Myonectin Is an Exercise-Induced Myokine That Protects the Heart from IschemiaReperfusion Injury: N. Otaka, et al.; Circ. Res. 123, 1326 (2018)
|
|
5. |
Erythroferrone inhibits the induction of hepcidin by BMP6: J. Arezes, et al.; Blood 132, 1473 (2018)
|
|
6. |
Erythropoietic regulators of iron metabolism: T. Ganz; Free Radic. Biol. Med. 133, 69 (2019)
|
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
LBIS® 小鼠胰岛素 ELISA 试剂盒(T 型) LBIS® Insulin-Mouse-T
LBIS® 小鼠胰岛素 ELISA 试剂盒(T 型)
LBIS® Insulin-Mouse-T
- 产品特性
- 相关资料
- Q&A
- 参考文献
LBIS® Insulin-Mouse-T
LBIS® 小鼠胰岛素 ELISA 试剂盒(T 型)

胰岛素是由胰脏内的胰岛β细胞分泌,分子量约 5800,等电点在 5.4 左右的一种蛋白质激素。
A6-A11、A7-B7、A20-B-19 之间形成二硫键,在酸性溶液或者不含 Zn 离子的中性水溶液中形成二聚体,在含锌离子的中性溶液中,则形成含2个 Zn 离子的六聚体。
肝脏、肌肉、脂肪组织是主要的靶组织,分别有以下的作用。
肝脏:促进糖原、蛋白质、脂肪酸合成、促进糖类的摄取和利用、抑制糖异生。
肌肉:糖类、氨基酸、K细胞膜通透性增大、促进糖原、蛋白质的合成、抑制蛋白质分解。
脂肪组织:葡萄糖细胞膜通透性增大、促进脂肪酸的合成。
胰岛素是细胞内的合成单链胰岛素原通过二硫键结合一起形成的。在酶分解作用下被激活,C肽和胰岛素分离。
◆特点
● 短时间测定(总的反应时间:3小时)
● 微量样品(标准操作:10 μL)可测
● 使用对环境无害的防腐剂
● 全部试剂均为液体,可直接使用
● 精密的测定精度和高再现性
● 操作简便,不需要特别的预处理
● 有效期限为 12 个月
◆构成
|
组成部分 |
状态 |
容量 |
|
(A) 抗体固相化 96孔板 |
洗净后使用 |
96 wells(8×12)/1 块 |
|
(B) 胰岛素标准溶液(小鼠)(200 ng/mL) |
稀释后使用 |
25 μL/1 瓶 |
|
(C) 缓冲液 |
即用 |
60 mL/1 瓶 |
|
(D) 生物素结合抗胰岛素抗体 |
稀释后使用 |
10 μL/1 瓶 |
|
(E) 过氧化物・抗生物素蛋白结合物 |
稀释后使用 |
20 μL/1 瓶 |
|
(F) 显色液(TMB) |
即用 |
12 mL/1 瓶 |
|
(H) 反应终止液(1M H2SO4)※小心轻放 |
即用 |
12 mL/1 瓶 |
|
( I ) 浓缩洗净液(10×) |
稀释后使用 |
100 mL/1 瓶 |
|
封板膜 |
3 张 |
|
|
使用说明书 |
1 份 |
◆样品信息
小鼠的血清、血浆、培养液
10 μL/well(标准操作)
※血浆采血建议使用肝素处理血液
◆测量范围
0.156~10 ng/mL(标准曲线范围)
◆Validation data
精度测试(组内变异)
|
样品 |
A |
B |
C |
D |
|
mean |
0.882 |
1.15 |
3.67 |
5.25 |
|
SD |
0.0245 |
0.0213 |
0.0649 |
0.0792 |
|
CV(%) |
2.78 |
1.87 |
1.77 |
1.51 |
单位:ng/mL n=10
重复性测试(组间变异)
|
测量日/样品 |
E |
F |
G |
|
第0天 |
5.253 |
1.224 |
0.513 |
|
第1天 |
5.322 |
1.312 |
0.523 |
|
第2天 |
5.365 |
1.269 |
0.512 |
|
第3天 |
5.362 |
1.281 |
0.535 |
|
mean |
5.326 |
1.272 |
0.521 |
|
SD |
0.0520 |
0.0366 |
0.0109 |
|
CV(%) |
3.31 |
3.76 |
4.65 |
单位:ng/mL n=3
加标回收测试
样品H
|
添加量 |
实测值 |
回收量 |
回收率(%) |
|
0 |
1.350 |
– |
– |
|
0.25 |
1.593 |
0.243 |
97.2 |
|
0.50 |
1.841 |
0.491 |
98.2 |
|
0.75 |
2.065 |
0.715 |
95.3 |
|
1.00 |
2.299 |
0.949 |
94.9 |
单位:ng/mL n=3
样品I
|
添加量 |
实测值 |
回收量 |
回收率(%) |
|
0 |
1.941 |
– |
– |
|
0.50 |
2.496 |
0.505 |
101 |
|
0.75 |
2.728 |
0.737 |
98.3 |
|
1.00 |
2.955 |
0.964 |
96.4 |
|
1.50 |
3.431 |
1.440 |
96.0 |
单位:ng/mL n=3
稀释直线性测试
用稀释缓冲液分3次连续稀释3个血清样品的测量结果,直线回归方程的 R2在 0.993~0.999 之间。
参考文献
|
1. |
Endoplasmic Reticulum Stress in Mice Increases Hepatic Expression of Genes Carrying a Premature Termination Codon via a Nutritional Status-Independent GRP78-Dependent Mechanism.Harada N, Okuyama M, Yoshikatsu A, Yamamoto H, Ishiwata S, Hamada C, Hirose T, Shono M, Kuroda M, Tsutsumi R, Takeo J, Taketani Y, Nakaya Y, Sakaue H.J Cell Biochem. 2017 Nov;118(11):3810-3824. |
|
2. |
Effects of β-Glucan Content and Pearling of Barley in Diet-Induced Obese MiceSeiichiro Aoe, Yasunori Ichinose, Noriko Kohyama, Kozo Komae, Asuka Takahashi, Toji Yoshioka, and Takashi Yanagisawa.Posted online on 27 Sep 2017. https://doi.org/10.1094/CCHEM-04-17-0083-R |
|
3. |
10-Hydroxy-2-decenoic acid, a natural product, improves hyperglycemia and insulin resistance in obese/diabetic KK-Ay mice, but does not prevent obesity Risa WATADANI, Jun KOTOH, Daiki SASAKI, Azusa SOMEYA, Kozo MATSUMOTO, Akihiko MAEDA Journal of Veterinary Medical Science, Vol. 79 (2017) No. 9 Sept, p.1596-1602 |
|
4. |
S-Equol Activates cAMP Signaling at the Plasma Membrane of INS-1 Pancreatic β-Cells and Protects against Streptozotocin-Induced Hyperglycemia by Increasing β-Cell Function in Male Mice. Horiuchi H, Usami A, Shirai R, Harada N, Ikushiro S, Sakaki T, Nakano Y, Inui H, Yamaji R. J Nutr. 2017 Sep;147(9):1631-1639. |
|
5. |
Pathological and gene expression analysis of a polygenic diabetes model, NONcNZO10/LtJ mice. Hirata T, Yoshitomi T, Inoue M, Iigo Y, Matsumoto K, Kubota K, Shinagawa A. Gene. 2017 Sep 20;629:52-58. |
|
6. |
Suppression of GRK2 expression reduces endothelial dysfunction by restoring glucose homeostasis. Taguchi K, Hida M, Hasegawa M, Narimatsu H, Matsumoto T, Kobayashi T. Sci Rep. 2017 Aug 16;7(1):8436. |
|
7. |
Gender difference in NASH susceptibility: Roles of hepatocyte Ikkβ and Sult1e1. Matsushita N, Hassanein MT, Martinez-Clemente M, Lazaro R, French SW, Xie W, Lai K, Karin M, Tsukamoto H. PLoS One. 2017 Aug 10;12(8):e0181052. |
|
8. |
Intake of mulberry 1-deoxynojirimycin prevents colorectal cancer in mice. E S, Yamamoto K, Sakamoto Y, Mizowaki Y, Iwagaki Y, Kimura T, Nakagawa K, Miyazawa T, Tsuduki T. J Clin Biochem Nutr. 2017 Jul;61(1):47-52. |
|
9. |
Sake lees extract improves hepatic lipid accumulation in high fat diet-fed mice. Kubo H, Hoshi M, Matsumoto T, Irie M, Oura S, Tsutsumi H, Hata Y, Yamamoto Y, Saito K Lipids Health Dis. 2017 Jun 3;16(1):106. |
|
10. |
Moringa oleifera from Cambodia Ameliorates Oxidative Stress, Hyperglycemia, and Kidney Dysfunction in Type 2 Diabetic Mice. Tang Y, Choi EJ, Han WC, Oh M, Kim J, Hwang JY, Park PJ, Moon SH, Kim YS, Kim EK. J Med Food. 2017 May;20(5):502-510. |
|
11. |
4μ8C Inhibits Insulin Secretion Independent of IRE1α RNase Activity. Sato H, Shiba Y, Tsuchiya Y, Saito M, Kohno K. Cell Struct Funct. 2017 May 3;42(1):61-70 |
|
12. |
Inhibition of Gastric Inhibitory Polypeptide Receptor Signaling in Adipose Tissue Reduces Insulin Resistance and Hepatic Steatosis in High-Fat Diet-Fed Mice. Joo E, Harada N, Yamane S, Fukushima T, Taura D, Iwasaki K, Sankoda A, Shibue K, Harada T, Suzuki K, Hamasaki A, Inagaki N. Diabetes. 2017 Apr;66(4):868-879. |
|
13. |
Prevention and treatment effect of evogliptin on hepatic steatosis in high-fat-fed animal models. Kim MK, Chae YN, Ahn GJ, Shin CY, Choi SH, Yang EK, Sohn YS, Son MH Arch Pharm Res. 2017 Feb;40(2):268-281. |
|
14. |
Royal jelly improves hyperglycemia in obese/diabetic KK-Ay mice. Mei YOSHIDA, Kaori HAYASHI, Risa WATADANI, Yoshiyasu OKANO, Keiya TANIMURA, Jun KOTOH, Daiki SASAKI, Kozo MATSUMOTO, Akihiko MAEDA Journal of Veterinary Medical Science, Vol. 79 (2017) No. 2 February p. 299-307 |
|
15. |
PDK1-FoxO1 pathway in AgRP neurons of arcuate nucleus promotes bone formation via GHRH-GH-IGF1 axis. Sasanuma H, Nakata M, Parmila K, Nakae J, Yada T. Mol Metab. 2017 Feb 17;6(5):428-439. |
|
16. |
Soy Protein Isolate Suppresses Lipodystrophy-induced Hepatic Lipid Accumulation in Model Mice. Nagao K, Matsumoto A, Kai S, Kayashima T, Yanagita T. J Oleo Sci. 2017 Feb 1;66(2):161-169. |
|
17. |
A high-fat diet temporarily renders Sod1-deficient mice resistant to an oxidative insult. Ito J, Ishii N, Akihara R, Lee J, Kurahashi T, Homma T, Kawasaki R, Fujii J J Nutr Biochem. 2017 Feb;40:44-52. |
|
18. |
Macrophage ubiquitin-specific protease 2 modifies insulin sensitivity in obese mice. Saito N, Kimura S, Miyamoto T, Fukushima S, Amagasa M, Shimamoto Y, Nishioka C, Okamoto S, Toda C, Washio K, Asano A, Miyoshi I, Takahashi E, Kitamura H. Biochem Biophys Rep. 2017 Jan 26;9:322-329. |
|
19. |
Dietary Mung Bean Protein Reduces Hepatic Steatosis, Fibrosis, and Inflammation in Male Mice with Diet-Induced, Nonalcoholic Fatty Liver Disease. Watanabe H, Inaba Y, Kimura K, Asahara SI, Kido Y, Matsumoto M, Motoyama T, Tachibana N, Kaneko S, Kohno M, Inoue H. J Nutr. 2017 Jan;147(1):52-60. |
|
20. |
BCL11B gene heterozygosity causes weight loss accompanied by increased energy consumption, but not defective adipogenesis, in mice Jun Inoue, Yusuke Ihara, Daisuke Tsukamoto, Keisuke Yasumoto, Tsutomu Hashidume, Kenya Kamimura, Shigeki Hirano, Makoto Shimizu, Ryo Kominami & Ryuichiro Sato Bioscience, Biotechnology, and Biochemistry, Vol.81, 2017,Issue 5, p922-930 |
|
21. |
Macrophage ubiquitin-specific protease 2 modifies insulin sensitivity in obese mice. Natsuko Saitoa,Shunsuke Kimurac,Tomomi Miyamotod,Sanae Fukushimae,Misato Amagasaa,Yoshinori Shimamotob, Chieko Nishiokae,Shiki Okamotof,Chitoku Todag,Kohei Washioa,Atsushi Asanoh,Ichiro Miyoshid,Eiki Takahashie,Hiroshi Kitamura Biochemistry and Biophysics Reports,Volume 9, March 2017, Pages 322-329 |
|
22. |
Agmatine ameliorates type 2 diabetes induced-Alzheimer’s disease-like alterations in high-fat diet-fed mice via reactivation of blunted insulin signalling. Kang S, Kim CH, Jung H, Kim E, Song HT, Lee JE. Neuropharmacology. 2017 Feb;113(Pt A):467-479 |
|
23. |
Dietary nitrite reverses features of postmenopausal metabolic syndrome induced by high fat diet and ovariectomy in mice. Ohtake K, Ehara N, Chiba H, Nakano G, Sonoda K, Ito J, Uchida H, Kobayashi J. Am J Physiol Endocrinol Metab. 2017 Feb 14 |
|
24. |
A high-fat diet temporarily renders Sod1-deficient mice resistant to an oxidative insult. Ito J, Ishii N, Akihara R, Lee J, Kurahashi T, Homma T, Kawasaki R, Fujii J. J Nutr Biochem. 2017 Feb;40:44-52. |
|
25. |
Inhibition of Gastric Inhibitory Polypeptide Receptor Signaling in Adipose Tissue Reduces Insulin Resistance and Hepatic Steatosis in High Fat Diet-Fed Mice. Joo E, Harada N, Yamane S, Fukushima T, Taura D, Iwasaki K, Sankoda A, Shibue K, Harada T, Suzuki K, Hamasaki A, Inagaki N. Diabetes. 2017 Jan 17. |
|
26. |
BCL11B gene heterozygosity causes weight loss accompanied by increased energy consumption, but not defective adipogenesis, in mice. Inoue J, Ihara Y, Tsukamoto D, Yasumoto K, Hashidume T, Kamimura K, Hirano S, Shimizu M, Kominami R, Sato R. Biosci Biotechnol Biochem. 2017 Jan 9:1-9. |
|
27. |
Attenuated secretion of glucose-dependent insulinotropic polypeptide (GIP) does not alleviate hyperphagic obesity and insulin resistance in ob/ob mice. Satoko Shimazu-Kuwahara,Norio Harada,Shunsuke Yamane,Erina Joo,Akiko Sankoda,Timothy J. Kieffer,Nobuya Inagaki. Molecular Metabolism,Available online 19 January 2017 |
|
28. |
Dietary Mung Bean Protein Reduces Hepatic Steatosis, Fibrosis, and Inflammation in Male Mice with Diet-Induced, Nonalcoholic Fatty Liver Disease. Watanabe H, Inaba Y, Kimura K, Asahara SI, Kido Y, Matsumoto M, Motoyama T, Tachibana N, Kaneko S, Kohno M, Inoue H. J Nutr. 2017 Jan;147(1):52-60. |
|
29. |
Germinated Pigmented Rice (Oryza Sativa L. cv. Superhongmi) Improves Glucose and Bone Metabolisms in Ovariectomized Rats. Chung SI, Ryu SN, Kang MY. Nutrients. 2016 Oct 21;8(10). |
|
30. |
Angiopoietin-like peptide 4 regulates insulin secretion and islet morphology. Kim HK, Kwon O, Park KH, Lee KJ, Youn BS, Kim SW, Kim MS. Biochem Biophys Res Commun. 2017 Feb 7 |
|
31. |
Ubc13 haploinsufficiency protects against age-related insulin resistance and high-fat diet-induced obesity. Joo E, Fukushima T, Harada N, Reed JC, Matsuzawa SI, Inagaki N. Sci Rep. 2016 Oct 31;6:35983. |
|
32. |
Procyanidin Promotes Translocation of Glucose Transporter 4 in Muscle of Mice through Activation of Insulin and AMPK Signaling Pathways. Yamashita Y, Wang L, Nanba F, Ito C, Toda T, Ashida H. PLoS One. 2016 Sep 6;11(9):e0161704 |
|
33. |
Oxytocin Protects against Stress-Induced Cell Death in Murine Pancreatic β-Cells. Watanabe S, Wei FY, Matsunaga T, Matsunaga N, Kaitsuka T, Tomizawa K. Sci Rep. 2016 May 4;6:25185. |
|
34. |
Loss of circadian rhythm of circulating insulin concentration induced by high-fat diet intake is associated with disrupted rhythmic expression of circadian clock genes in the liver. Honma K, Hikosaka M, Mochizuki K, Goda T. Metabolism. 2016 Apr;65(4):482-91 |
|
35. |
Sodium alginate prevents progression of non-alcoholic steatohepatitis and liver carcinogenesis in obese and diabetic mice. Miyazaki T, Shirakami Y, Kubota M, Ideta T, Kochi T, Sakai H, Tanaka T, Moriwaki H, Shimizu M. Oncotarget. 2016 Mar 1;7(9):10448-58. |
|
36. |
Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Nishimoto S, Fukuda D, Higashikuni Y, Tanaka K, Hirata Y, Murata C, Kim-Kaneyama JR, Sato F, Bando M, Yagi S, Soeki T, Hayashi T, Imoto I, Sakaue H, Shimabukuro M, Sata M. Sci Adv. 2016 Mar 25;2(3):e1501332 |
|
37. |
Fatty Liver and Insulin Resistance in the Liver-Specific Knockout Mice of Mitogen Inducible Gene-6. Park BK, Lee EA, Kim HY, Lee JC, Kim KS, Jeong WH, Kim KY, Ku BJ, Rhee SD. J Diabetes Res. 2016;2016:1632061 |
|
38. |
Reactive sulfur species regulate tRNA methylthiolation and contribute to insulin secretion. Takahashi N, Wei FY, Watanabe S, Hirayama M, Ohuchi Y, Fujimura A, Kaitsuka T, Ishii I, Sawa T, Nakayama H, Akaike T, Tomizawa K. |
|
39. |
Effects of caloric restriction on O-GlcNAcylation, Ca(2+) signaling, and learning impairment in the hippocampus of ob/ob mice. Jeon BT, Heo RW, Jeong EA, Yi CO, Lee JY, Kim KE, Kim H, Roh GS. Neurobiol Aging. 2016 Aug;44:127-37. |
|
40. |
Chronic Repression of mTOR Complex 2 Induces Changes in the Gut Microbiota of Diet-induced Obese Mice. Jung MJ, Lee J, Shin NR, Kim MS, Hyun DW, Yun JH, Kim PS, Whon TW, Bae JW. Sci Rep. 2016 Jul 29;6:30887. |
|
41. |
Single ingestion of soy β-conglycinin induces increased postprandial circulating FGF21 levels exerting beneficial health effects. Hashidume T, Kato A, Tanaka T, Miyoshi S, Itoh N, Nakata R, Inoue H, Oikawa A, Nakai Y, Shimizu M, Inoue J, Sato R. Sci Rep. 2016 Jun 17;6:28183. |
|
42. |
Paraventricular NUCB2/Nesfatin-1 Supports Oxytocin and Vasopressin Neurons to Control Feeding Behavior and Fluid Balance in Male Mice. Nakata M, Gantulga D, Santoso P, Zhang B, Masuda C, Mori M, Okada T, Yada T. Endocrinology. 2016 Jun;157(6):2322-32. |
|
43. |
Oxytocin Protects against Stress-Induced Cell Death in Murine Pancreatic β-Cells. Watanabe S, Wei FY, Matsunaga T, Matsunaga N, Kaitsuka T, Tomizawa K. Sci Rep. 2016 May 4;6:25185. |
|
44. |
Loss of circadian rhythm of circulating insulin concentration induced by high-fat diet intake is associated with disrupted rhythmic expression of circadian clock genes in the liver. Honma K, Hikosaka M, Mochizuki K, Goda T. Metabolism. 2016 Apr;65(4):482-91. |
|
45. |
Protective effect of vitamin E against alloxan-induced mouse hyperglycemia. Takemoto K, Doi W, Masuoka N. Biochim Biophys Acta. 2016 Apr;1862(4):647-50. |
|
46. |
Castration influences intestinal microflora and induces abdominal obesity in high-fat diet-fed mice. Harada N, Hanaoka R, Horiuchi H, Kitakaze T, Mitani T, Inui H, Yamaji R. Sci Rep. 2016 Mar 10;6:23001. |
|
47. |
Pharmacological Inhibition of Monoacylglycerol O-Acyltransferase 2 Improves Hyperlipidemia, Obesity, and Diabetes by Change in Intestinal Fat Utilization. Take K, Mochida T, Maki T, Satomi Y, Hirayama M, Nakakariya M, Amano N, Adachi R, Sato K, Kitazaki T, Takekawa S. PLoS One. 2016 Mar 3;11(3):e0150976. |
|
48. |
GADD34-deficient mice develop obesity, nonalcoholic fatty liver disease, hepatic carcinoma and insulin resistance Naomi Nishio and Ken-ichi Isobe Sci Rep. 2015; 5: 13519. |
|
49. |
Patterns of Brain Activation and Meal Reduction Induced by Abdominal Surgery in Mice and Modulation by Rikkunshito Lixin Wang, Sachiko Mogami, Seiichi Yakabi, Hiroshi Karasawa, Chihiro Yamada, Koji Yakabi, Tomohisa Hattori, and Yvette Taché PLoS One. 2015; 10(9): e0139325. |
|
50. |
Hot water extracts of edible Chrysanthemum morifolium Ramat. exert antidiabetic effects in obese diabetic KK-Ay mice Yamamoto J, Tadaishi M, Yamane T, Oishi Y, Shimizu M, Kobayashi-Hattoria K. Bioscience, Biotechnology, and Biochemistry, Vol.79(7), 2015. |
|
51. |
Dietary obacunone supplementation stimulates muscle hypertrophy, and suppresses hyperglycemia and obesity through the TGR5 and PPARγ pathway. Horiba T, Katsukawa M, Mita M, Sato R. Biochem Biophys Res Commun. Vol.463(4), p846-52, Aug. 2015. |
|
52. |
Hepatic STAMP2 alleviates high fat diet-induced hepatic steatosis and insulin resistance. Kim HY, Park SY, Lee MH, Rho JH, Oh YJ, Jung HU, Yoo SH, Jeong NY, Lee HJ, Suh S, Seo SY, Cheong J, Jeong JS, Yoo YH. J Hepatol. Vol.63(2), p477-85, Aug 2015. |
|
53. |
Optogenetic control of insulin secretion by pancreatic β-cells in vitro and in vivo. Kushibiki T, Okawa S, Hirasawa T, Ishihara M. Gene Ther. Vol.22(7), p553-9, Jul 2015. |
|
54. |
Preventive effects of astaxanthin on diethylnitrosamine-induced liver tumorigenesis in C57/BL/KsJ-db/db obese mice. Ohno T, Shimizu M, Shirakami Y, Miyazaki T, Ideta T, Kochi T, Kubota M, Sakai H, Tanaka T, Moriwaki H. Hepatol Res. Jul 2015 |
|
55. |
Effects of liquid konjac on parameters related to obesity in diet-induced obese mice. Aoe S, Kudo H, Sakurai S. Biosci Biotechnol Biochem. Vol.79(7), p1141-6, Jul 2015. |
|
56. |
Alteration of gut microbiota by vancomycin and bacitracin improves insulin resistance via glucagon-like peptide 1 in diet-induced obesity. Hwang I, Park YJ, Kim YR, Kim YN, Ka S, Lee HY, Seong JK, Seok YJ, Kim JB. FASEB J. Vol.29(6), p2397-411, Jun 2015. |
|
57. |
PRMT4 is involved in insulin secretion via the methylation of histone H3 in pancreatic β cells. Kim JK, Lim Y, Lee JO, Lee YS, Won NH, Kim H, Kim HS. J Mol Endocrinol.Vol.54(3), p315-24, Jun 2015. |
|
58. |
Hepatic NPC1L1 overexpression ameliorates glucose metabolism in diabetic mice via suppression of gluconeogenesis. Kurano M, Hara M, Satoh H, Tsukamoto K. Metabolism. Vol.64(5), p588-96, May 2015. |
|
59. |
Chronic high intake of quercetin reduces oxidative stress and induces expression of the antioxidant enzymes in the liver and visceral adipose tissues in mice. Kobori M, Takahashi Y, Akimoto Y, Sakurai M, Matsunaga I, Nishimuro H, Ippoushi K, Oike H, Ohnishi-Kameyama M. Journal of Functional Foods, Vol.15, p551–560, May 2015. |
|
60. |
Effects of quercetin derivatives from mulberry leaves: Improved gene expression related hepatic lipid and glucose metabolism in short-term high-fat fed mice. Sun X, Yamasaki M, Katsube T, Shiwaku K. Nutr Res Pract. Vol.9(2), p137-43, Apr 2015. |
|
61. |
Insulin Release from the Beta Cells in Acatalasemic Mice Is Highly Susceptible to Alloxan-Induced Oxidative Stress. Kazunori Takemoto, Wakana Doi, Ken Kataoka, Kohji Ishihara, Da-Hong Wang., Hitoshi Sugiyama, Noriyoshi Masuoka. JDM, Vol.5 No.2, May 2015 |
|
62. |
Titanium dioxide nanoparticles increase plasma glucose via reactive oxygen species-induced insulin resistance in mice. Hu H, Guo Q, Wang C, Ma X, He H, Oh Y, Feng Y, Wu Q, Gu N. J Appl Toxicol. Mar 2015 . |
|
63. |
Compensatory hyperinsulinemia in high-fat diet-induced obese mice is associated with enhanced insulin translation in islets. Kanno A, Asahara S, Masuda K, Matsuda T, Kimura-Koyanagi M, Seino S, Ogawa W, Kido Y. Biochem Biophys Res Commun. Vol.13;458(3), p681-6. Mar 2015. |
|
64. |
Optogenetic control of insulin secretion by pancreatic β-cells in vitro and in vivo. Kushibiki T, Okawa S, Hirasawa T, Ishihara M. Gene Ther. Mar 2015. |
|
65. |
Compensatory hyperinsulinemia in high-fat diet-induced obese mice is associated with enhanced insulin translation in islets. Kanno A, Asahara S, Masuda K, Matsuda T, Kimura-Koyanagi M, Seino S, Ogawa W, Kido Y. Biochem Biophys Res Commun. Vol.458(3), p681-6, Mar 2015. |
|
66. |
Essential role of mitochondrial Ca2+ uniporter in the generation of mitochondrial pH gradient and metabolism-secretion coupling in insulin-releasing cells. Quan X, Nguyen TT, Choi SK, Xu S, Das R, Cha SK, Kim N, Han J, Wiederkehr A, Wollheim CB, Park KS. J Biol Chem. Vol.290(7), p4086-96, Feb 2015. |
|
67. |
Endogenous Interleukin 18 Suppresses Hyperglycemia and Hyperinsulinemia during the Acute Phase of Endotoxemia in Mice. Yamashita H, Aoyama-Ishikawa M, Takahara M, Yamauchi C, Inoue T, Miyoshi M, Maeshige N, Usami M, Nakao A, Kotani J. Surg Infect (Larchmt). 2015 Feb;16(1):90-6. |
|
68. |
Hot water extracts of edible Chrysanthemum morifolium Ramat. exert antidiabetic effects in obese diabetic KK-Ay mice. Junpei Yamamoto, Miki Tadaishi, Takumi Yamane, Yuichi Oishi, Makoto Shimizu & Kazuo Kobayashi-Hattoria. Bioscience, Biotechnology, and Biochemistry, Published online: 10 Feb 2015 |
|
69. |
Alteration of gut microbiota by vancomycin and bacitracin improves insulin resistance via glucagon-like peptide 1 in diet-induced obesity. Hwang I, Park YJ, Kim YR1, Kim YN, Ka S, Lee HY, Seong JK, Seok YJ, Kim JB. FASEB J. Feb 2015. |
|
70. |
Titanium dioxide nanoparticles increase plasma glucose via reactive oxygen species-induced insulin resistance in mice. Hu H, Guo Q, Wang C, Ma X, He H, Oh Y, Feng Y, Wu Q, Gu N. J Appl Toxicol. Mar 2015. |
|
71. |
Ashitaba (Angelica keiskei) extract prevents adiposity in high-fat diet-fed C57BL/6 mice. Zhang T, Yamashita Y, Yasuda M, Yamamoto N, Ashida H. Food Funct. Vol.6(1), p134-144, Jan 2015. |
|
72. |
Dietary nitrite supplementation improves insulin resistance in type 2 diabetic KKAy mice Ohtake K, Nakano G, Ehara N, Sonoda K, Ito J, Uchida H, Kobayashi J. Nitric Oxide, Vol.44, p31–38, Jan 2015. |
|
73. |
Salicornia herbacea prevents weight gain and hepatic lipid accumulation in obese ICR mice fed a high-fat diet. Pichiah PT, Cha YS. J Sci Food Agric. Dec 2014. |
|
74. |
Salacia reticulata has therapeutic effects on obesity. Shimada T, Nakayama Y, Harasawa Y, Matsui H, Kobayashi H, Sai Y, Miyamoto K, Tomatsu S, Aburada M. J Nat Med. Vol.68(4), p668-676, Oct 2014.Salicornia herbacea prevents weight gain and hepatic lipid accumulation in obese ICR mice fed a high-fat diet. Pichiah PT1, Cha YS. J Sci Food Agric. Dec 2014. |
|
75. |
Ghrelin administered spinally increases the blood glucose level in mice. Sim Y-B., Park S-H., Kim S-S., Kim C-H., Kim S-J., Lim S-M., Jung J-S., Suh H-W. Peptides, Vol.54, p162-165, Apr 2014.
|
|
76. |
Chronic exposure to valproic acid promotes insulin release, reduces KATP channel current and does not affect Ca2+ signaling in mouse islets. Manaka K., Nakata M., Shimomura K., Rita RS., Maejima Y., Yoshida M., Dezaki K., Kakei M., Yada T. The Journal of Physiological Sciences, Vol.64(1), p77-83, Jan 2014. |
|
77. |
Impaired Lipid and Glucose Homeostasis in Hexabromocyclododecane-Exposed Mice Fed a High-Fat Diet. Yanagisawa R., Koike E., Win-Shwe TT., Yamamoto M. and Takano H. ENVIRONMENTAL HEALTH PERSPECTIVES, Jan 2014. |
|
78. |
Lipid-Lowering Effects of Pediococcus acidilactici M76 Isolated from Korean Traditional Makgeolli in High Fat Diet-Induced Obese Mice. Moon Y-J., Baik S-H. and Cha Y-S. Nutrients, Vol.6(3), p1016-1028, 2014. |
|
79. |
Azilsartan, an angiotensin II type 1 receptor blocker, restores endothelial function by reducing vascular inflammation and by increasing the phosphorylation ratio Ser1177/Thr497 of endothelial nitric oxide synthase in diabetic mice. Matsumoto S., Shimabukuro M., Fukuda D., Soeki T., Yamakawa K., Masuzaki H. and Sata M. Cardiovascular Diabetology, 13:30, 2014. |
|
80. |
Intake of mulberry 1-deoxynojirimycin prevents diet-induced obesity through increases in adiponectin in mice. T.Tsuduki, I.Kikuchi, T.Kimura, K.Nakagawa, T.Miyazawa. Food Chemistry, Vol.139(1-4), p16-23, Aug 2013. |
|
81. |
Chronic treatment with novel GPR40 agonists improve whole-body glucose metabolism based on the glucose-dependent insulin secretion. H.Tanaka, S.Yoshida, H.Oshima, H.Minoura, K.Negoro, T.Yamazaki, S.Sakuda, F.Iwasaki, T.Matsui and M. Shibasaki. JPET, Jul 2013. |
|
82. |
Contribution of insulin signaling to the regulation of pancreatic beta-cell mass during the catch-up growth period in a low birth weight mouse model. Y.Yoshida, M.Fuchita, M.Kimura-Koyanagi, A.Kanno, T.Matsuda, S.Asahara, N.Hashimoto, T.Isagawa, W.Ogawa, H.Aburatani, T.Noda, S.Seino, M.Kasuga, Y.Kido. Diabetology International, Jul 2013. |
|
83. |
Differential contribution of insulin and amino acids to the mTORC1-autophagy pathway in the liver and muscle. T.Naito, A.Kuma and N.Mizushima. The Journal of Biological Chemistry, Jun 2013. |
|
84. |
Apelin Inhibits Diet-Induced Obesity by Enhancing Lymphatic and Blood Vessel Integrity. M.Sawane, K.Kajiya, H.Kidoya, M.Takagi, F.Muramatsu and N.Takakura. Diabetes, Vol.62(6), p1970-1980, Jun 2013. |
|
85. |
Ras-related C3 botulinum toxin substrate 1 (RAC1) regulates glucose-stimulated insulin secretion via modulation of F-actin. S.Asahara, Y.Shibutani, K.Teruyama, H.Y.Inoue, Y.Kawada, H.Etoh, T.Matsuda, M.Kimura-Koyanagi, N.Hashimoto, M.Sakahara, W.Fujimoto, H.Takahashi, S.Ueda, T.Hosooka, T.Satoh, H.Inoue, M.Matsumoto, A.Aiba, M.Kasuga, Y.Kido. Diabetologia, Vol.56(5), p1088-1097, May 2013. |
|
86. |
Effects of hydrophilic statins on renal tubular lipid accumulation in diet-induced obese mice. K.Gotoh, T.Masaki, S.Chiba, H.Ando, K.Fujiwara, T.Shimasaki, Y.Tawara, I.Toyooka, K.Shiraishi, K.Mitsutomi, M.Anai, E.Itateyama, J.Hiraoka, K.Aoki, N.Fukunaga, T.Nawata, T.Kakuma. Obesity Research & Clinical Practice, May 2013. |
|
87. |
Amyloid-β Induces Hepatic Insulin Resistance In Vivo via JAK2. Y.Zhang, B.Zhou, B.Deng, F.Zhang, J.Wu, Y.Wang, Y.Le and Q.Zhai. Diabetes, Vol.62(4), p1159-1166, Apr 2013. |
|
88. |
Histidine augments the suppression of hepatic glucose production by central insulin action Kimura K, Nakamura Y, Inaba Y, Matsumoto M, Kido Y, Asahara S, Matsuda T, Watanabe H, Maeda A, Inagaki F, Mukai C, Takeda K, Akira S, Ota T, Nakabayashi H, Kaneko S, Kasuga M and Inoue H. Diabetes, Vol.62(4), p1003-1004, Apr 2013 |
|
89. |
Improved transplantation outcome through delivery of DNA encoding secretion signal peptide-linked glucagon-like peptide-1 into mouse islets Chae H Y, Lee M, Hwang H J, Kim H A, Kang J G, Kim C S, Lee S J, Ihm S-H. Transplant International, Vol.26(4), p443-452, Apr 2013. |
|
90. |
Histidine augments the suppression of hepatic glucose production by central insulin action K.Kimura, Y.Nakamura, Y.Inaba, M.Matsumoto, Y.Kido, S.Asahara, T.Matsuda, H.Watanabe, A.Maeda, F.Inagaki, C.Mukai, K.Takeda, S.Akira, T.Ota, H.Nakabayashi, S.Kaneko, M.Kasuga and H.Inoue. Diabetes, Mar 2013. |
|
91. |
Wogonin ameliorates hyperglycemia and dyslipidemia via PPARα activation in db/db mice without adverse side effects. Bak E-J, Kim J-H, Lee D-E, Choi Y-H, Kim J M, Woo G-H, Cha J-H, Yoo Y-J. Clinical Nutrition, Available online 26, Mar 2013. |
|
92. |
Extracellular Signal-Regulated Kinase in the Ventromedial Hypothalamus Mediates Leptin-Induced Glucose Uptake in Red-Type Skeletal Muscle. Toda C, Shiuchi T, Kageyama H, Okamoto S, Coutinho E A, Sato T, Okamatsu-Ogura Y, Yokota S, Takagi K, Tang L, Saito K, Shioda S and Minokoshi Y. Diabetes Mar 2013. |
|
93. |
Effect of vitamin E on alloxan-induced mouse diabetes. Kamimura W, Doi W, Takemoto K, Ishihara K, Wang D-H, Sugiyama H, Oda S, Masuoka N. Clinical Biochemistry, Mar 2013. |
|
94. |
Ablation of Rnf213 retards progression of diabetes in the Akita mouse. Kobayashi H, Yamazaki S, Takashima S, Liu W, Okuda H, Yan J, Fujii Y, Hitomi T, Harada K H, Habu T, Koizumi A. Biochemical and Biophysical Research Communications, Vol.432(3), p519-525, Mar 2013.
|
|
95. |
Hypothalamic ATF3 is involved in regulating glucose and energy metabolism in mice. Lee Y-S, Sasaki T, Kobayashi M, Kikuchi O, Kim H-J, Yokota-Hashimoto H, Shimpuku M, Susanti V-Y, Ido-Kitamura Y, Kimura K, Inoue H, Tanaka-Okamoto M, Ishizaki H, Miyoshi J, Ohya S, Tanaka Y, Kitajima S, Kitamura T. Diabetologia, Mar 2013. |
|
96. |
Ras-related C3 botulinum toxin substrate 1 (RAC1) regulates glucose-stimulated insulin secretion via modulation of F-actin. S. Asahara, Y. Shibutani, K. Teruyama, H. Y. Inoue, Y. Kawada, H. Etoh, T. Matsuda, M. Kimura-Koyanagi, N. Hashimoto, M. Sakahara, W. Fujimoto, H. Takahashi, S. Ueda, T. Hosooka, T. Satoh, H. Inoue, M. Matsumoto, A. Aiba, M. Kasuga, Y. Kido. Diabetologia, Feb 2013. |
|
97. |
Toll-like receptor 2 and palmitic acid cooperatively contribute to the development of nonalcoholic steatohepatitis through inflammasome activation in mice. Miura K, Yang L, Rooijen N, Brenner D A, Ohnishi H, Seki E. Hepatology, Vol.57(2), p577-589, Feb 2013. |
|
98. |
Transcriptional Regulatory Factor X6 (Rfx6) Increases Gastric Inhibitory Polypeptide (GIP) Expression in Enteroendocrine K-cells and Is Involved in GIP Hypersecretion in High Fat Diet-induced Obesity*. K.Suzuki, N.Harada, S.Yamane, Y.Nakamura, K.Sasaki, D.Nasteska, E.Joo, K.Shibue, T.Harada, A.Hamasaki, K.Toyoda, K.Nagashima and N.Inagaki. The Journal of Biological Chemistry, Vol.288, p1929-1938, Jan 2013. |
|
99. |
Improved hypothermic short-term storage of isolated mouse islets by adding serum to preservation solutions. Yasuko Kimura, Teru Okitsu, Liu Xibao, Hiroki Teramae, Atsuhito Okonogi, Kentaro Toyoda, Shinji Uemoto and Masanori Fukushima. Islets, Vol.5(1), Jan 2013. |
|
100. |
Anti-diabetic effect of amorphastilbol through PPARα/γ dual activation in db/db mice. Lee W, Ham J, Kwon H C, Kim Y K, Kim S-N. Biochemical and Biophysical Research Communications, Jan 2013. |
|
101. |
Transcriptional Regulatory Factor X6 (Rfx6) Increases Gastric Inhibitory Polypeptide (GIP) Expression in Enteroendocrine K-cells and Is Involved in GIP Hypersecretion in High Fat Diet-induced Obesity. Suzuki K, Harada N, Yamane S, Nakamura Y, Sasaki K, Nasteska D, Joo E, Shibue K, Harada T, Hamasaki A,Toyoda K, Nagashima K and Inagaki N. The Journal of Biological Chemistry, Vol.288, p1929-1938, Jan 2013. |
|
102. |
Apelin inhibits diet-induced obesity by enhancing lymphatic and blood vessel integrity. Sawane M, Kajiya K, Kidoya H, Takagi M, Muramatsu F and Takakura N. Diabetes, 2013. |
|
103. |
Beneficial effects of Allium sativum L. stem extract on lipid metabolism and antioxidant status in obese mice fed a high fat diet. Kim I, Kim H-R, Kim J-H, Om A-S. Journal of the Science of Food and Agriculture, 2013. |
|
104. |
Intake of mulberry 1-deoxynojirimycin prevents diet-induced obesity through increases in adiponectin in mice. Tsuduki T, Kikuchi I, Kimura T, Nakagawa K, Miyazawa T. Food Chemistry, Vol.139(14), p16-23, 2013. |
|
105. |
Effect of Mukitake mushroom (Panellus serotinus) on the pathogenesis of lipid abnormalities in obese, diabetic ob/ob mice. Inoue N, Inafuku M, Shirouchi B, Nagao K and Yanagita T. Lipids in Health and Disease, Vol.12(18), 2013. |
|
106. |
Pax6 Directly Down-Regulates Pcsk1n Expression Thereby Regulating PC1/3 Dependent Proinsulin Processing. Liu T., Zhao Y., Tang N., Feng R., Yang X., Lu N., Wen J., Li L. PLOS ONE, Vol.7(10), Oct 2012. |
|
107. |
Anti-Diabetic Atherosclerosis Effect of Prunella vulgaris in db/db Mice with Type 2 Diabetes. Hwang S M, Kim J K, Lee Y J, Yoon J J, Lee S M, Kang D G, Lee H S. Am J Chin Med, Vol.40, 2012. |
|
108. |
Prevention mechanisms of glucose intolerance and obesity by cacao liquor procyanidin extract in high-fat diet-fed C57BL/6 mice. Y. Yamashita., M. Okabe., M. Natsume., H. Ashida. Archives of Biochemistry and Biophysics, Available online 23 March 2012, In Press |
|
109. |
The Action of D-Dopachrome Tautomerase as an Adipokine in Adipocyte Lipid Metabolism. T. Iwata., H. Taniguchi., M. Kuwajima., T. Taniguchi., Y. Okuda., A. Sukeno., K. Ishimoto., N. Mizusawa., K. Yoshimoto. PLos ONE, Vol. 7(3), Mar 2012. |
|
110. |
Soymorphin-5, a soy-derived μ-opioid peptide, decreases glucose and triglyceride levels through activating adiponectin and PPARα systems in diabetic KKAy mice. Y. Yamada.,.A. Muraki.,.M. Oie.,.N. Kanegawa.,.A. Oda., Y. Sawashi., K. Kaneko., M. Yoshikawa., T. Goto., N. Takahashi., T. Kawada., and K. Ohinata. American Physiological Society, Vol.302, No.4, E433-E440, 2012. |
|
111. |
Effects of Gametophytes of Ecklonia Kurome on the Levels of Glucose and Triacylglycerol in db/db, Prediabetic C57BL/6J and IFN-γ KO Mice. F. Dwiranti., M. Hiraoka., T. Taguchi., Y. Konishi., M. Tominaga., A. Tominaga. Int J B 64 iomed Sci, Vol.8, No.1, Mar 2012. |
|
112. |
Endoplasmic Reticulum Stress Inhibits STAT3-Dependent Suppression of Hepatic Gluconeogenesis via Dephosphprylation and Deacetylation. K. Kimura., T. Yamada., M. Matsumoto., Y. Kido., T. Hosooka., S. Asahara., T. Matsuda., T. Ota., H. Watanabe., Y. Sai., K. Miyamoto., S. Kaneko., M. Kasuga., H. Inoue. Diabetes, Vol.61, No.1, p61-73, 2012. |
|
113. |
Melatonin protects mice with intermittent hypoxia from oxidative stress-induced pancreatic injury. LI G., HOU G., LU W., KANG J. Sleep and Biological Rhythms, Vol.9(2), p78-85, Apr 2011. |
|
114. |
A novel dipeptidyl peptidase IV inhibitor DA-1229 ameliorates streptozotocin-induced diabetes by increasing β-cell replication and neogenesis. J, M, Cho., H, W, Jang., H, Cheon.,Y, T, Jeong., D-H, Kim., Y-M, Lim., S, Choi., E, Yang., C-Y, Shin., M, H, Son., S, H, Kim., H, Kim., M, Lee. Diabetes Research and Clinical Practice.Vol. 91(1), p72-79, 2011. |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 634-01481 | (AKRIN-011T)LBIS® Insulin-Mouse-T | 96 tests | – | – |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
LBIS® 小鼠胰岛素 ELISA 试剂盒(RTU) LBIS® Mouse Insulin ELISA KIT(RTU)
LBIS® 小鼠胰岛素 ELISA 试剂盒(RTU)
LBIS® Mouse Insulin ELISA KIT(RTU)
- 产品特性
- 相关资料
- Q&A
- 参考文献
LBIS® Mouse Insulin ELISA KIT(RTU)![]()
LBIS® 小鼠胰岛素 ELISA 试剂盒(RTU)
胰岛素是由胰脏内的胰岛β细胞分泌,分子量约 5800,等电点在 5.4 左右的一种蛋白质激素。
A6-A11、A7-B7、A20-B-19 之间形成二硫键,在酸性溶液或者不含 Zn 离子的中性水溶液中形成二聚体,在含锌离子的中性溶液中,则形成含2个 Zn 离子的六聚体。
肝脏、肌肉、脂肪组织是主要的靶组织,分别有以下的作用。
肝脏:促进糖原、蛋白质、脂肪酸合成、促进糖类的摄取和利用、抑制糖异生。
肌肉:糖类、氨基酸、K细胞膜通透性增大、促进糖原、蛋白质的合成、抑制蛋白质分解。
脂肪组织:葡萄糖细胞膜通透性增大、促进脂肪酸的合成。
胰岛素是细胞内的合成单链胰岛素原通过二硫键结合一起形成的。在酶分解作用下被激活,C肽和胰岛素分离。
◆特点
● 测量范围广(100~12,000 pg/mL)
● 短时间测定(总的反应时间:2小时50分钟)
● 微量样品(标准操作:10 μL)可测
● 使用对环境无害的防腐剂
● 全部试剂均为液体,可直接使用
● 精密的测定精度和高再现性
● 有效期限为12个月
◆构成
|
组成部分 |
状态 |
容量 |
|
(A) 抗体固相化 96 孔板 |
洗净后使用 |
96 wells(8×12)/1 块 |
|
(B)胰岛素标准溶液(小鼠) ①12,000 ②4,800 ③2,000 ④800 ⑤300 ⑥100 (pg/mL) |
稀释后使用 |
各100 μL/1 瓶 |
|
(C) 缓冲液 |
即用 |
60 mL/1 瓶 |
|
(D) 生物素结合抗胰岛素抗体 |
稀释后使用 |
12 μL/1 瓶 |
|
(E) 过氧化物・抗生物素蛋白结合物 |
稀释后使用 |
12 μL/1 瓶 |
|
(F) 显色液(TMB) |
即用 |
12 mL/1 瓶 |
|
(H) 反应终止液(1M H2SO4)※小心轻放 |
即用 |
12 mL/1 瓶 |
|
( I ) 浓缩洗净液(10×) |
稀释后使用 |
100 mL/1 瓶 |
|
封板膜 |
3 张 |
|
|
使用说明书 |
1 份 |
◆样品信息
小鼠的血清•血浆•培养液
10 μL/well(标准操作)
※血浆采血建议使用肝素处理血液
◆测量范围
100~12,000 pg/mL(标准曲线范围)
◆Validation data
精度测试(组内变异)
|
样品 |
A |
B |
C |
|
1 |
844 |
1559 |
5348 |
|
2 |
831 |
1584 |
5419 |
|
3 |
829 |
1555 |
5377 |
|
4 |
826 |
1591 |
5329 |
|
5 |
833 |
1599 |
5299 |
|
6 |
841 |
1525 |
5304 |
|
mean |
834 |
1569 |
5346 |
|
SD |
7.04 |
27.9 |
45.9 |
|
CV(%) |
0.84 |
1.8 |
0.86 |
单位:pg/mL
重复性测试(组间变异)
|
测量日/样品 |
D |
E |
F |
|
第0天 |
442 |
3510 |
6919 |
|
第1天 |
441 |
3494 |
6878 |
|
第2天 |
441 |
3500 |
6836 |
|
第3天 |
435 |
3533 |
6827 |
|
mean |
440 |
3510 |
6865 |
|
SD |
3.45 |
17.0 |
42.0 |
|
CV(%) |
0.78 |
0.48 |
0.61 |
单位:pg/mL n=3
加标回收测试
样品G
|
添加量 |
实测值 |
回收量 |
回收率(%) |
|
0.00 |
322 |
– |
– |
|
150 |
466 |
144 |
96.0 |
|
300 |
613 |
291 |
97.0 |
|
600 |
917 |
595 |
99.2 |
|
1200 |
1558 |
1266 |
106 |
单位:pg/mL n=3
样品H
|
添加量 |
实测值 |
回收量 |
回收率(%) |
|
0.00 |
1672 |
– |
– |
|
500 |
2162 |
490 |
98.0 |
|
1500 |
3202 |
1530 |
102 |
|
3000 |
4573 |
2901 |
96.7 |
|
4500 |
6001 |
4329 |
96.2 |
单位:pg/mL n=3
稀释直线性测试
用稀释缓冲液分4次连续稀释2个血清样品的测量结果,直线回归方程的R2在0.9988~0.9998之间。
参考文献
|
1. |
Deficiency of COX7RP, a mitochondrial supercomplex assembly promoting factor, lowers blood glucose level in mice. Shiba S, Ikeda K, Horie-Inoue K, Nakayama A, Tanaka T, Inoue S. Sci Rep. 2017 Aug 8;7(1):7606. |
|||
|
2. |
Long-term dietary nitrite and nitrate deficiency causes the metabolic syndrome, endothelial dysfunction and cardiovascular death in mice. Kina-Tanada M, Sakanashi M, Tanimoto A, Kaname T, Matsuzaki T, Noguchi K, Uchida T, Nakasone J, Kozuka C, Ishida M, Kubota H, Taira Y, Totsuka Y, Kina SI, Sunakawa H, Omura J, Satoh K, Shimokawa H, Yanagihara N, Maeda S, Ohya Y, Matsushita M, Masuzaki H, Arasaki A, Tsutsui M. Diabetologia. 2017 Jun;60(6):1138-1151. |
|||
|
3. |
α-Mangostin ameliorates hepatic steatosis and insulin resistance by inhibition C-C chemokine receptor 2. Kim HM, Kim YM, Huh JH, Lee ES, Kwon MH, Lee BR, Ko HJ, Chung CH. PLoS One. 2017 Jun 9;12(6):e0179204 |
|||
|
4. |
Long-term dietary nitrite and nitrate deficiency causes the metabolic syndrome, endothelial dysfunction and cardiovascular death in mice. Kina-Tanada M, Sakanashi M, Tanimoto A, Kaname T, Matsuzaki T, Noguchi K, Uchida T, Nakasone J, Kozuka C, Ishida M, Kubota H, Taira Y, Totsuka Y, Kina SI, Sunakawa H, Omura J, Satoh K, Shimokawa H, Yanagihara N, Maeda S, Ohya Y, Matsushita M, Masuzaki H, Arasaki A, Tsutsui M. Diabetologia. 2017 Jun;60(6):1138-1151. |
|||
|
5. |
Anti-diabetic effects of luteolin and luteolin-7-O-glucoside on KK-A(y) mice. Zang Y, Igarashi K, Li Y. Biosci Biotechnol Biochem. 2016 Aug;80(8):1580-6. |
|||
|
6. |
Insulin-Inducible SMILE Inhibits Hepatic Gluconeogenesis. Lee JM, Seo WY, Han HS, Oh KJ, Lee YS, Kim DK, Choi S, Choi BH, Harris RA, Lee CH, Koo SH, Choi HS Diabetes. 2016 Jan;65(1):62-73. |
|||
|
7. |
Metabolomics-based search for therapeutic agents for non-alcoholic steatohepatitis Yoshihiko Terashima, Shin Nishiumi , Akihiro Minami, Yuki Kawano, Namiko Hoshi, Takeshi Azuma, Masaru Yoshida, Archives of Biochemistry and Biophysics, Vol.555–556, p55-65, Aug 2014.
|
|||
|
8. |
Indirect Effects of Glucagon-Like Peptide-1 Receptor Agonist Exendin-4 on the Peripheral Circadian Clocks in Mice. Hitoshi Ando,Kentarou Ushijima,Akio Fujimura PLoS One. 2013 Nov 15;8(11):e81119. |
|||
|
9. |
Effects of Two Types of Non-Digestible Carbohydrates on Energy Metabolism in Mice. Akiyama, Takashi; Nakatani, Sachie; Kobata, Kenji; Wada, Masahiro Journal of Chitin and Chitosan Science, Vol.2, Number 3, p223-232(10), Sep 2014. |
|||
|
10. |
Cinnamtannin A2, a Tetrameric Procyanidin, Increases GLP-1 and Insulin Secretion in Mice. Yamashita Y, Okabe M, Natsume M, Ashida H. Bioscience, Biotechnology, and Biochemistry , Vol.77(4), 2013. |
|||
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 633-23919 | (AKRIN-011RU)LBIS® Mouse Insulin ELISA Kit(RTU) LBIS® 小鼠胰岛素 ELISA试剂盒(RTU) |
96 tests | – | – |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
ENZ-KIT134-0001载脂蛋白E ELISA 试剂盒 ApoE ELISA kit
高灵敏度载脂蛋白E ELISA 试剂盒可在3.5h内检测血清、血浆、细胞培养物上清和组织匀浆中的载脂蛋白E。
◆特点
● 灵敏度低至14.063 ng/mL
● 与相似蛋白的反应性可忽略不计
● 高通量,仅需3.5个小时便可获得结果
● 完全定量结果优于半定量Western blot分析
载脂蛋白E ELISA 试剂盒是一款比色法免疫测定试剂盒,可在3.5小时内得到结果。
◆产品规格
别称:载脂蛋白E
灵敏度:14.063 ng/mL (23.438-1500 ng/mL)
反应时长:3.5 小时
应用:ELISA、比色法检测
应用须知:定量测定血清、血浆、细胞培养物的上清液和人样品中的组织匀浆中的ApoE。
种属反应性:人
运输:冰袋运输
长期储存:+4°C
目录:微量滴定板,标准液,样品缓冲液,洗涤缓冲液浓缩液,抗体,抗体缓冲液,结合物,结合物缓冲液底物和终止液
科学背景:载脂蛋白E(ApoE)将脂蛋白,脂溶性维生素和胆固醇运输到淋巴系统,然后再运输到血液。它主要在肝脏中合成,但也已在其他组织(例如大脑,肾脏和脾脏)中被发现。在神经系统中,非神经元细胞类型(主要是星形胶质细胞和小胶质细胞)是ApoE的主要产生者,而神经元则优先表达ApoE的受体。最初ApoE在脂蛋白代谢和心血管疾病中的重要性被得到认可。已经研究了ApoE在几种生物过程中的作用,包括:III型高脂蛋白血症(HLP III),阿尔茨海默氏病(AD),免疫调节和认知。
UniProt ID:P02649
※ 本页面产品仅供研究用,研究以外不可使用。
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| ENZ-KIT134-0001 | ApoE ELISA kit 载脂蛋白E ELISA 试剂盒 |
96 wells |