ES细胞・iPS细胞培养用血清代替品

StemSure® Serum Replacement
本产品是ES细胞和iPS细胞培养中使用的血清代替品。血清含有分化诱导因子,会导致干细胞分化。使用本产品代替血清,可在ES和iPS细胞培养的同时,保持他们的未分化状态,达到稳定培养。
本产品不含剧毒物质,将其作为普通物质处理。
使用本产品配制培养基培养的小鼠ES细胞,可用于制备嵌合体小鼠,并确认其种系传递。

◆特点•优势
● 可用于嵌合体小鼠制备,并确认其种系传递。
● 作为血清替代品,用于小鼠ES细胞・人IPS细胞培养。
● 不含剧毒物质。
◆案例•应用
1、嵌合体小鼠的制备与种系传递Update!!
将组装 HaloTag® cDNA 的目标载体导入小鼠ES细胞,用含有 StemSure® Serum Replacement(SSR)的培养基培养。确认载体导入小鼠ES细胞后,将其注入至 ICR 小鼠的胚盘胞,并移植至 ICR 小鼠的子宫。得到的嵌合体小鼠与 C57BL/6J 小鼠交配,获得F1小鼠。
(1) 嵌合体小鼠
收集嵌合体小鼠的血液,用 TRITC(四甲基若丹明异硫氰酸盐)对 HaloTag® 蛋白质染色。发现小鼠ES细胞源的 HaloTag® 的血液被染色,可确认为嵌合化。

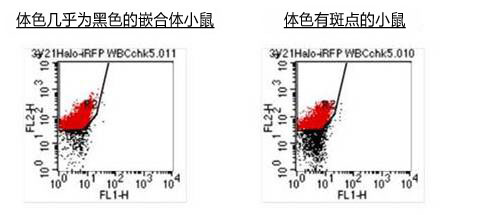
(2) F1小鼠
F1小鼠的血液发现 HaloTag® 存在,可确认用 SSR 培养基培养的ES细胞嵌合小鼠能够正常存活。

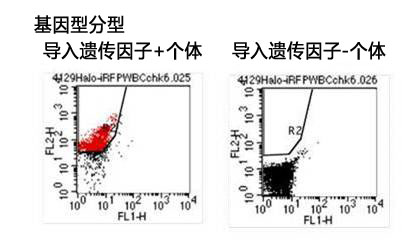
2、人iPS细胞201B7的培养
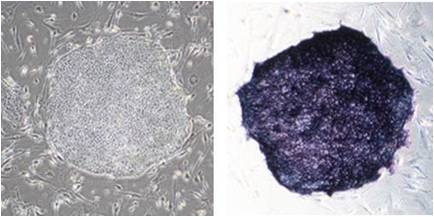
(1) 克隆形态与ALP染色
已确认可用 StemSure® Serum Replacement(SSR)培养人iPS细胞 201B7 株。ALP 染色呈阳性。
<培养基组成>
D-MEM/Ham’s F-12 + 20% SSR + 2 mmol/L L-Glutamine +1×MEM Non-essential Amino Acids + 0.1 mmol/L StemSure® 2-Mercaptoethanol + 1×Penicillin-Streptomycin + 5 ng/mL bFGF
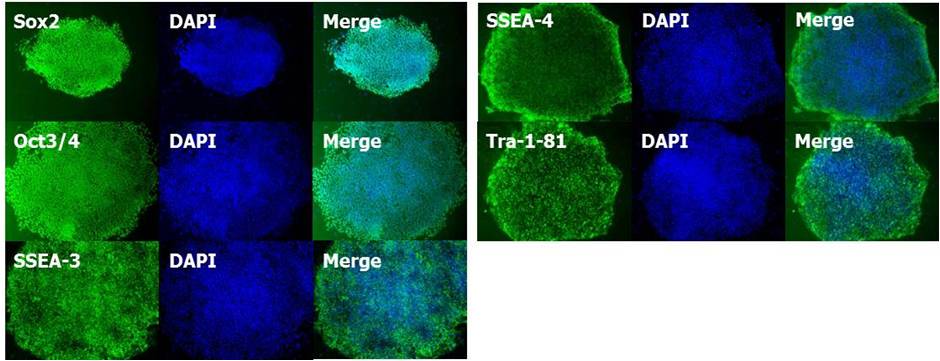
(2) 未分化标记的发现
使用 StemSure® Serum Replacement(SSR)培养的人iPS细胞201B7株,确认各种未分化标记(Sox2, Oct3/4, SSEA-3, SSEA-4, Tra-1-81)呈阳性。
3、小鼠ES细胞D3的培养
(1) 细胞形态与ALP染色
使用 StemSure® Serum Replacement(SSR)培养小鼠ES细胞D3,能观察到小鼠ES细胞群特有的光泽,ALP染色呈阳性。
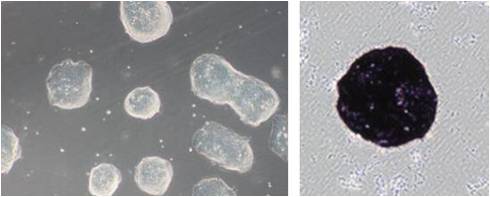
(2) 细胞增殖曲线
用不同培养基培养小鼠ES细胞D3进行14继代培养,比较细胞增殖。
如下图所示StemSure® 系列与A公司有同等的性能。
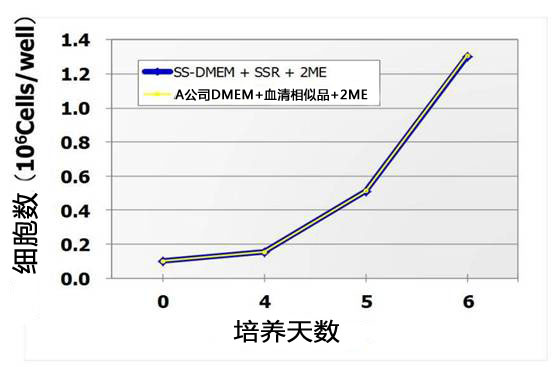
< StemSure® 系列培养基组成>
StemSure® D-MEM + 15% SSR + 2 mmol/L L-Glutamine + 1×MEM Non-essentialAmino Acids + 0.1 mmol/L StemSure® 2-Mercaptoethanol + 1×Penicillin-Streptomycin + 1,000 units/mL StemSure® LIF
(使用胶原包被的12孔板)
(3) 细胞群倍加数*
使用不同培养基对小鼠ES细胞D3进行继代培养,检查培养天数与细胞群倍加数的关系。
下图显示 StemSure® 系列与A公司产品的细胞群倍加数相同。
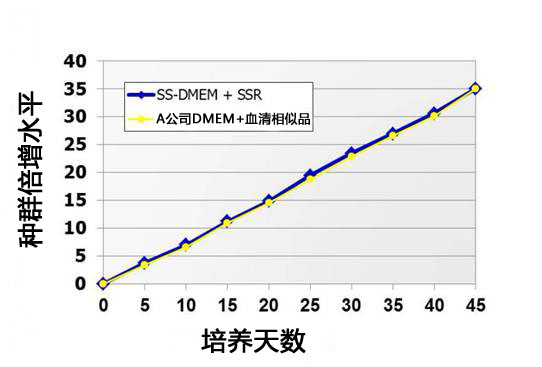
*细胞群倍加数 cell population doubling level,缩写PDL,指从培养开始至现在细胞群的倍增次数。
<培养基组成>
StemSure® D-MEM + 15% SSR + 2 mmol/l L-Glutamine + 1×MEM Non-essentialAmino Acids + 0.1 mmol/l StemSure® 2-Mercaptoethanol + 1×Penicillin-Streptomycin + 1,000 units/ml StemSure® LIF
(使用胶原包被的12孔板)
(4) 未分化标记的检测
使用 StemSure® 系列对小鼠ES细胞D3进行5代继代培养,各种未分化标记(Nanog, Oct3/4, Sox2, SSEA-1)呈阳性。
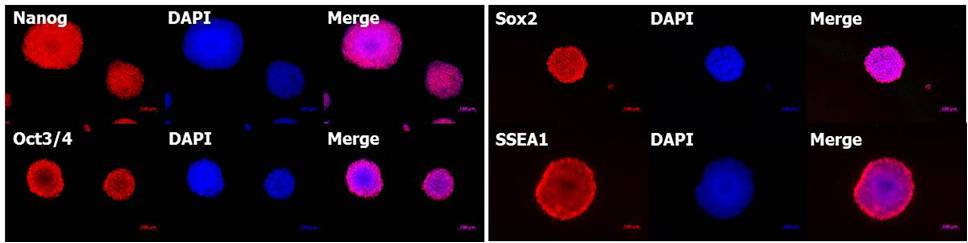
<培养基组成>
StemSure® D-MEM + 15% SSR + 2 mmol/L L-Glutamine + 1×MEM Non-essential Amino Acids + 0.1 mmol/L StemSure® 2-Mercaptoethanol+ 1×Penicillin-Streptomycin + 1,000 units/mL StemSure® LIF
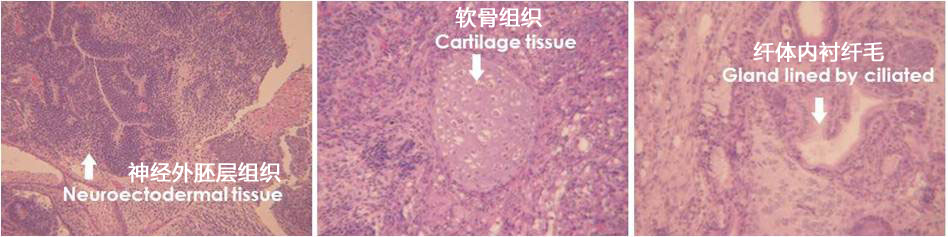
4、畸形瘤的形成
用 StemSure® 系列对小鼠ES细胞D3进行继代培养。对免疫不全小鼠的皮下注射培养后细胞。在形成皮下畸形瘤,其内部检测出神经组织(外胚叶源)、软骨组织(中胚叶源)、管腔结构纤毛上皮(内胚叶源)。
<培养基组成 >
StemSure® D-MEM + 15% SSR + 2 mmol/L L-Glutamine + 1×MEM Non-essential Amino Acids + 0.1 mmol/L StemSure® 2-Mercaptoethanol+ 1×Penicillin-Streptomycin + 1,000 units/mL StemSure® LIF
 |
|
|
★StemSure® 系列★
StemSure® 系列可培养ES细胞和iPS細胞。使用小鼠ES细胞D3检测每批产品的品质。
● StemSure® D-MEM・巯基乙醇,硫代甘油
● StemSure® 明胶溶液
● StemSure® LIF, 小鼠, 重组. 溶液,
● StemSure® 冻存溶液
| 产品编号 |
产品名称 |
等 级 |
规 格 |
价格 |
保存温度・法规情报 |
|
|
197-16275 |
StemSure® D-MEM (High Glucose) with Phenol Red and Sodium Pyruvate |
细胞培养用 |
500 mL |
询价 |
||
|
198-15781 |
StemSure® 10mmol/l 2-Mercaptoethanol Solution (×100) |
细胞培养用 |
100 mL |
询价 |
||
|
195-15791 |
StemSure® 50mmol/L Monothioglycerol Solution (×100) 与2ME同等使用的还原剂。不属于毒物。 |
细胞培养用 |
100 mL |
询价 |
||
|
190-15805 |
StemSure® 0.1w/v% Gelatin Solution |
细胞培养用 |
500 mL |
询价 |
||
|
199-16051 |
StemSure® LIF, Mouse, recombinant, Solution |
细胞培养用 |
106 units 106 units×10 |
询价 |
||
|
195-16031 |
StemSure® Freezing Medium |
细胞培养用 |
100 mL |
询价 | ||
已有案例引用的培养基配方
iPSC培养基组成如下:含15%StemSure Serum Replacement(197-16775; Wako Pure Chemical Industries) DMEM / F12,1%抗生素 – 抗真菌混合溶液,1%非必需氨基酸(139-15651; Wako Pure Chemical Industries ),2mM谷氨酸(16948-004; Nacalai Tesque)和0.1mMβ-巯基乙醇(21438-82; Nacalai Tesque)。文献全文请点击参考文献页面。
|
1. |
Obora, K., Onodera, Y., Takehara, T., Frampton, J., Hasei, J., Ozaki, T., … & Fukuda, K. (2017). Inflammation-induced miRNA-155 inhibits self-renewal of neural stem cells via suppression of CCAAT/enhancer binding protein β (C/EBPβ) expression. Scientific reports, 7, 43604.【mouse neural stem cell (NSC)】
|
|
2. |
Aihara, A., Koike, T., Abe, N., Nakamura, S., Sawaguchi, A., Nakamura, T., … & Eto, K. (2017). Novel TPO receptor agonist TA-316 contributes to platelet biogenesis from human iPS cells. Blood advances, 1(7), 468-476.
|
|
3. |
Katayama, M., Kiyono, T., Kuroda, K., Ueda, K., Onuma, M., Shirakawa, H., & Fukuda, T. (2019). Rat-derived feeder cells immortalized by expression of mutant CDK4, cyclin D, and telomerase can support stem cell growth. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 1866(5), 945-956.
|
|
4. |
Katayama, M., Hirayama, T., Horie, K., Kiyono, T., Donai, K., Takeda, S., … & Fukuda, T. (2016). Induced pluripotent stem cells with six reprogramming factors from prairie vole, which is an animal model for social behaviors. Cell transplantation, 25(5), 783-796.【prairie vole-derived iPSCs(pv-iPSCs)】
|
|
5. |
Kawata, M., Taniguchi, Y., Mori, D., Yano, F., Ohba, S., Chung, U. I., … & Saito, T. (2017). Different regulation of limb development by p63 transcript variants. PloS one, 12(3), e0174122.【基因编辑小鼠iPS细胞】
|
|
6. |
Bui, P. L., Nishimura, K., Mondejar, G. S., Kumar, A., Aizawa, S., Murano, K., … & Ito, Y. (2019). Template Activating Factor-I α Regulates Retroviral Silencing during Reprogramming. Cell reports, 29(7), 1909-1922. 【Mouse embryonic fibroblasts (MEFs) 】
|
|
7. |
Sumi, S., Kawagoe, M., Abe, R., Yanai, G., Yang, K. C., & Shirouzu, Y. (2017). A multiple-funnels cell culture insert for the scale-up production of uniform cell spheroids. Regenerative therapy, 7, 52-60.
|
|
8. |
古田明日香, & 中村肇伸. (2019). ES 細胞は代謝シフトを介して全能性細胞へと変化する. In 日本繁殖生物学会 講演要旨集 第 112 回日本繁殖生物学会大会 (pp. AW1-5). 日本繁殖生物学会.
|
|
9. |
Onozato, D., Yamashita, M., Nakanishi, A., Akagawa, T., Kida, Y., Ogawa, I., … & Matsunaga, T. (2018). Generation of intestinal organoids suitable for pharmacokinetic studies from human induced pluripotent stem cells. Drug Metabolism and Disposition, 46(11), 1572-1580.
|
|
10. |
Hayashi, Y., Matsumoto, J., Kumagai, S., Morishita, K., Xiang, L., Kobori, Y., … & Sumaru, K. (2018). Automated adherent cell elimination by a high-speed laser mediated by a light-responsive polymer. Communications biology, 1(1), 218.【hiPSC differentiation】
|
|
11. |
Osafune, K., Toyoda, T., Takekawa, S., Nakamura, G., & Ito, R. (2019). U.S. Patent Application No. 16/490,394.
|
|
12. |
Kato, T., Kanemura, Y., Shofuda, T., & Fukusumi, H. (2016). U.S. Patent Application No. 14/900,975.
|
|
13. |
Eitoku, M., Kato, H., Suganuma, N., & Kiyosawa, H. (2018). Markers associated with neuron-specific Ube3a imprinting during neuronal differentiation of mouse embryonic stem cells. Cytotechnology, 70(1), 45-53.
|
|
14. |
Onozato, D., Yamashita, M., Fukuyama, R., Akagawa, T., Kida, Y., Koeda, A., … & Matsunaga, T. (2018). Efficient generation of Cynomolgus monkey induced pluripotent stem cell-derived intestinal organoids with pharmacokinetic functions. Stem cells and development, 27(15), 1033-1045.
|
|
15. |
Katayama, M., Hirayama, T., Kiyono, T., Onuma, M., Tani, T., Takeda, S., … & Fukuda, T. (2017). Immortalized prairie vole-derived fibroblasts (VMF-K4DTs) can be transformed into pluripotent stem cells and provide a useful tool with which to determine optimal reprogramming conditions. Journal of Reproduction and Development, 2016-164.
|
|
16. |
Matsuyama, A., & Okura, H. (2017). U.S. Patent No. 9,644,181. Washington, DC: U.S. Patent and Trademark Office.
|
|
17. |
Tomizawa, M. (2016). Culture Medium And Method For Inducing Differentiation of Pluripotent Stem Cells To Hepatoblasts. U.S. Patent Application No. 14/749,715.
|
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| 191-18375 | Stemsure® Serum Replacement Stemsure®血清替代品 |
500 mL | 细胞培养用 |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |
